填空题 适中0.65 引用1 组卷176
氮气化学性质很稳定,可以通过氮的固定将空气中的氮气转化氮的化合物。氮的化合物可用于进一步合成化肥、炸药以及合成树脂等。
(1)写出氮分子的电子式______________。
(2)人工合成氨反应为N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
E.增加H2的浓度
(3)氨的接触氧化制取硝酸的过程中,900℃时,氨氧化反应阶段可能发生的反应有
反应Ⅲ的△H3=____________(用△H1、△H2表示);反应Ⅱ的平衡常数的表达式K2=__________;
该温度下K3的计算结果为__________。
(4)催化反硝法可用于治理水中硝酸盐的污染。催化反硝法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。反应的离子方程式为____________________________;其平均反应速率为v(NO3-)______________mol/(L•min)。
(5)实验室用下图所示装置制取NH3。若将收集NH3的试管改为集气瓶且瓶口向上排空气法收集NH3,并确保不污染环境,请画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。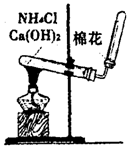
(1)写出氮分子的电子式______________。
(2)人工合成氨反应为N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。| A.分离出NH3 |
| B.加入催化剂 |
| C.升高温度 |
| D.增加N2的浓度 |
E.增加H2的浓度
(3)氨的接触氧化制取硝酸的过程中,900℃时,氨氧化反应阶段可能发生的反应有
| 编号 | 热化学方程式 | 平衡常数 |
| Ⅰ | 4NH3(g)+5O2(g) 4NO(g)+6H2O (g) △H1 4NO(g)+6H2O (g) △H1 | K1=1×1053 |
| Ⅱ | 4NH3(g)+3O2(g) 2N2(g)+6H2O (g) △H2 2N2(g)+6H2O (g) △H2 | K2=1×1065 |
| Ⅲ | 2NO(g) N2(g)+O2(g) △H3 N2(g)+O2(g) △H3 | K3 |
反应Ⅲ的△H3=____________(用△H1、△H2表示);反应Ⅱ的平衡常数的表达式K2=__________;
该温度下K3的计算结果为__________。
(4)催化反硝法可用于治理水中硝酸盐的污染。催化反硝法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。反应的离子方程式为____________________________;其平均反应速率为v(NO3-)______________mol/(L•min)。
(5)实验室用下图所示装置制取NH3。若将收集NH3的试管改为集气瓶且瓶口向上排空气法收集NH3,并确保不污染环境,请画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。

2015·广东梅州·二模
类题推荐
氮的化合物的处理和利用是环境科学研究的热点。
(1)机动车排放的尾气中主要污染物为NOx,可用CH4催化还原NOx以消除其污染。298K时,1.0g CH4(g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72.5kJ的热量。该反应的热化学方程式为_______ 。
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=_____ ;K1、K2、K3的关系为K3=______ 。
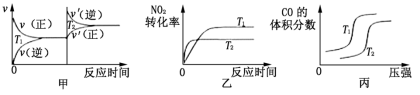
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1.对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图象正确的是_______ (填序号)。
(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=____ ;该反应的平衡常数K=_____ ;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______ (填序号);
A.加入一定量的活性炭
B.恒温恒压充入氩气
C.适当缩小容器的体积
D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率_______ (填“升高”或“降低”),反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)机动车排放的尾气中主要污染物为NOx,可用CH4催化还原NOx以消除其污染。298K时,1.0g CH4(g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72.5kJ的热量。该反应的热化学方程式为
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
| 热化学方程式 | 平衡常数 | |
| ① | 2NO2(g)+NaCl(s)⇌NaNO3(s)+NOCl(g) ΔH1 | K1 |
| ② | 4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 | K2 |
| ③ | 2NO(g)+Cl2(g)⇌2NOCl(g) ΔH3 | K3 |
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1.对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图象正确的是

(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是
A.加入一定量的活性炭
B.恒温恒压充入氩气
C.适当缩小容器的体积
D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网