解答题-实验探究题 适中0.65 引用1 组卷232
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应并获得反应液X。
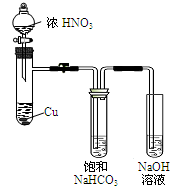
(1)①NaHCO3溶液呈碱性的原因是____ 。
②Cu与浓硝酸反应的现象是____ 。
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、____ 、过滤。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
④甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想。但经讨论后认为不可行,你认为其原因是____ 。
⑤乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则产物中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式____ 。
⑥已知在酸性条件下NO2-能将I-氧化为I2。你认为能否用KI淀粉溶液检验X中是否存在NaNO2:_______ (填“能”或“不能”),原因是____ 。
⑦已知5NO2-+ 2MnO4-+6H+= 5NO3-+ 2Mn2+ +3H2O。称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是____ ,则X中NaNO2的浓度是____ (用含a、b的式子表示)。
 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应并获得反应液X。

(1)①NaHCO3溶液呈碱性的原因是
②Cu与浓硝酸反应的现象是
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
④甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想。但经讨论后认为不可行,你认为其原因是
⑤乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则产物中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式
⑥已知在酸性条件下NO2-能将I-氧化为I2。你认为能否用KI淀粉溶液检验X中是否存在NaNO2:
⑦已知5NO2-+ 2MnO4-+6H+= 5NO3-+ 2Mn2+ +3H2O。称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是
2015·浙江金华·一模
类题推荐
某学习小组探究FeCl3溶液与Na2S溶液在某种条件下的反应。
实验Ⅰ
已知:FeS、Fe2S3均为黑色固体,难溶于水。
(1)用化学用语解释Na2S溶液呈碱性的原因___________ 。
(2)小组同学们试管b中黑色沉淀的提出猜想
猜想1::黑色沉淀是Fe2S3
猜想2::黑色沉淀是FeS
①针对猜想1,甲同学根据Na2S溶液呈碱性,推测试管b中黑色沉淀除Fe2S3外,还可能存在Fe(OH)3,补充实验II如下:
②甲同学继续查找数据:Ksp[Fe2S3]=1.0×10-88,Ksp[Fe(OH)3]=1.1×10-36,设计实验III:向Fe(OH)3中加入过量pH=12.5的0.1mol·L-1Na2S溶液,观察到的现象是沉淀颜色由___________ ,该现象对应的离子方程式为___________ 。
③针对猜想2,乙同学推测,若猜想2成立,应该还有S生成。写出该同学推测所依据的离子方程式___________ 。乙同学继续检验:进行实验并获取证据:取试管b中黑色沉淀,用水多次洗涤后,___________ ,确认黑色沉淀中无S单质,猜想2不成立。
(已知:Ksp(FeS)=1.59×10-19;H2S:Ka1=9.5×10-8,Ka2=1.3×10-14)
(3)丙同学利用电化学原理继续进行探究
丙同学依据实验IV得出结论:pH=1的0.1mol·L-1FeCl3溶液与pH=12.5的0.1mol·L-1Na2S溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,从反应原理角度分析试管b中黑色沉淀是Fe2S3而不是FeS的原因:___________ 。
实验Ⅰ

已知:FeS、Fe2S3均为黑色固体,难溶于水。
(1)用化学用语解释Na2S溶液呈碱性的原因
(2)小组同学们试管b中黑色沉淀的提出猜想
猜想1::黑色沉淀是Fe2S3
猜想2::黑色沉淀是FeS
①针对猜想1,甲同学根据Na2S溶液呈碱性,推测试管b中黑色沉淀除Fe2S3外,还可能存在Fe(OH)3,补充实验II如下:
| 编号 | 操作或过程 | 现象和结论 |
| 实验Ⅱ | 向 | 有红褐色溶液生成。试管b中黑色的Fe2S3可能影响Fe(OH)3红褐色的观察。 |
③针对猜想2,乙同学推测,若猜想2成立,应该还有S生成。写出该同学推测所依据的离子方程式
(已知:Ksp(FeS)=1.59×10-19;H2S:Ka1=9.5×10-8,Ka2=1.3×10-14)
(3)丙同学利用电化学原理继续进行探究
| 编号 | 装置 | 操作及现象 |
| 实验IV |  | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加K3[Fe(CN)6]溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加K3[Fe(CN)6]溶液,有大量蓝色沉淀。 |
(4)综合以上研究,从反应原理角度分析试管b中黑色沉淀是Fe2S3而不是FeS的原因:
Ⅰ:已知Na2CO3溶液中存在水解平衡:CO32﹣+H2O HCO3﹣+OH﹣,请用Na2CO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程,必需的试剂有;操作和现象是。
HCO3﹣+OH﹣,请用Na2CO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程,必需的试剂有;操作和现象是。
Ⅱ:沉淀滴定和中和滴定的原理相同,如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO为指示剂,这是因为AgCl的溶解度比Ag2CrO4的溶解度___________的缘故(填“大”或“小”),其实难溶性银盐较多,溶度积如下表:
若用AgNO3去滴定KSCN溶液,可选用为滴定的合适指示剂有( )
A.NaCl B.KI C.NaCN D.Na2CrO4
刚好达到滴定终点时,发生的离子反应方程式为______________。
Ⅲ:甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+ 5H2C2O4+ 6H+=2Mn2++10CO2+8H2O)
甲组:利用下图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。(实验中所用KMnO4溶液均已加入H2SO4)
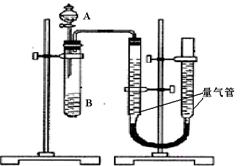
(1)该实验的目的是探究对化学反应速率的影响。
(2)分液漏斗中A溶液应该加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是。乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(4)上表上X=(填序号)
A.5 B.10 C.15 D.20
(5)4号实验中始终没有观察到溶液褪色,你认为可能的原因是。
 HCO3﹣+OH﹣,请用Na2CO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程,必需的试剂有;操作和现象是。
HCO3﹣+OH﹣,请用Na2CO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程,必需的试剂有;操作和现象是。Ⅱ:沉淀滴定和中和滴定的原理相同,如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO为指示剂,这是因为AgCl的溶解度比Ag2CrO4的溶解度___________的缘故(填“大”或“小”),其实难溶性银盐较多,溶度积如下表:
| 银盐 性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 沉淀颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| 溶度积 | 1.8×10-10 | 8.3×10-17 | 1.2×10-10 | 1.2×10-12 | 1.0×10-12 |
A.NaCl B.KI C.NaCN D.Na2CrO4
刚好达到滴定终点时,发生的离子反应方程式为______________。
Ⅲ:甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+ 5H2C2O4+ 6H+=2Mn2++10CO2+8H2O)
甲组:利用下图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。(实验中所用KMnO4溶液均已加入H2SO4)
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |

(1)该实验的目的是探究对化学反应速率的影响。
(2)分液漏斗中A溶液应该加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是。乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5 mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2 mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
A.5 B.10 C.15 D.20
(5)4号实验中始终没有观察到溶液褪色,你认为可能的原因是。
硫代硫酸钠是一种常见的化工原料,将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是________ 。
(2)用该方法获得的Na2S2O3∙5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究。
【提出假设】该晶体中含有的杂质可能是:Na2CO3、Na2SO3、_____ 、_____ 等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为___ 。
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:______________
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3mol/LH2SO4、1mol/LNaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知:2Na2S2O3+I2=2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L 的碘水进行多次取样滴定,测得Na2S2O3∙5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________ 。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是
(2)用该方法获得的Na2S2O3∙5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究。
【提出假设】该晶体中含有的杂质可能是:Na2CO3、Na2SO3、
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3mol/LH2SO4、1mol/LNaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2=2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L 的碘水进行多次取样滴定,测得Na2S2O3∙5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


