解答题-原理综合题 适中0.65 引用1 组卷332
氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
(1)常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42-三种微粒的物质的量浓度大小关系:_______________ 。
(2)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为____________ 。
(3)铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较):________________________________________ 。
(4)五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4+ KF + H2O2+ HF → K2MnF6+O2+ H2O
②SbCl5 + HF → SbF5+ HCl
③K2MnF6+ SbF5→ KSbF6 + MnF3+ F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为_________ ;反应③中SbF5表现的性质为________ 性。
(5)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3-和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19mL0.2mol/L的NaH2PO4溶液,81mL0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L pH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4- H++HPO42-,请根据该平衡体系分析其缓冲原理:
H++HPO42-,请根据该平衡体系分析其缓冲原理:________________________ 。
(1)常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42-三种微粒的物质的量浓度大小关系:
(2)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为
(3)铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
(4)五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4+ KF + H2O2+ HF → K2MnF6+O2+ H2O
②SbCl5 + HF → SbF5+ HCl
③K2MnF6+ SbF5→ KSbF6 + MnF3+ F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为
(5)能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3-和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19mL0.2mol/L的NaH2PO4溶液,81mL0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L pH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4-
 H++HPO42-,请根据该平衡体系分析其缓冲原理:
H++HPO42-,请根据该平衡体系分析其缓冲原理:14-15高三下·上海奉贤·阶段练习
类题推荐
完成下列填空:
(1)现有下列9种物质,① ②淀粉溶液 ③
②淀粉溶液 ③ ④
④ ⑤
⑤ ⑥
⑥ ⑦纯醋酸 ⑧
⑦纯醋酸 ⑧ 溶液 ⑨
溶液 ⑨ ,根据所学知识回答下列问题:属于强电解质的是
,根据所学知识回答下列问题:属于强电解质的是_______ (填写序号)。
(2)标准状况下,若④和⑤混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为_______ 。标准状况下, 溶入
溶入 中,溶液密度为
中,溶液密度为 ,则氨水物质的量浓度表达式为
,则氨水物质的量浓度表达式为_______ mol/L。
(3)现取一定量的硫酸酸化的硫酸锰( )溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
)溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
已知:①金属铋(Bi)价态为+3时较稳定, 无色;②铋酸钠(
无色;②铋酸钠( )无色,难溶于水;③淀粉溶液遇到
)无色,难溶于水;③淀粉溶液遇到 变成蓝色。
变成蓝色。
Ⅰ.请配平步骤②发生反应的化学方程式:

_______ 。
Ⅱ.由上述现象可得 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
根据上述结论,请写出 与KI溶液在酸性条件下反应的离子方程式
与KI溶液在酸性条件下反应的离子方程式_______ 。
(1)现有下列9种物质,①
(2)标准状况下,若④和⑤混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为
(3)现取一定量的硫酸酸化的硫酸锰(
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
Ⅰ.请配平步骤②发生反应的化学方程式:
Ⅱ.由上述现象可得
根据上述结论,请写出
完成下列填空:
(1)现有下列9种物质,① ②淀粉溶液 ③
②淀粉溶液 ③ ④
④ ⑤
⑤ ⑥
⑥ ⑦纯醋酸 ⑧
⑦纯醋酸 ⑧ 溶液 ⑨
溶液 ⑨ ,根据所学知识回答下列问题:属于强电解质的是
,根据所学知识回答下列问题:属于强电解质的是_______ (填写序号)。
(2)标准状况下,若④和⑤混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为_______ 。标准状况下,VL  溶入100mL
溶入100mL  (lg/mL)中,溶液密度为
(lg/mL)中,溶液密度为 g/mL,则氨水物质的量浓度为
g/mL,则氨水物质的量浓度为_______ mol/L。(用含 、V的表达式表示)
、V的表达式表示)
(3)现取一定量的硫酸酸化的硫酸锰( )溶液,向其中依次加入下列物质,对应的现象如下表所示:
)溶液,向其中依次加入下列物质,对应的现象如下表所示:
已知:①金属铋(Bi)价态为+3时较稳定, 无色;
无色;
②铋酸钠( ),难溶于水;
),难溶于水;
③淀粉溶液遇到 变成蓝色。
变成蓝色。
由上述现象可得 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。根据上述结论,请写出 与KI溶液在酸性条件下反应的离子方程式
与KI溶液在酸性条件下反应的离子方程式_______ 。
(4)实验室用胆矾配制100mL 的
的 溶液(已知胆矾溶于水使溶液温度降低)。
溶液(已知胆矾溶于水使溶液温度降低)。
①以下操作会引起所配制溶液浓度偏低的是_______ (填序号)。
a.容量瓶底部有少量水
b.胆矾溶于水后立即转移到容量瓶中
c.定容时仰视刻度线
d.胆矾长期放置失去部分结晶水
②现利用上述 溶液配制450mL
溶液配制450mL  的
的 溶液,需用量筒量取
溶液,需用量筒量取_______ mL上述 溶液。
溶液。
(1)现有下列9种物质,①
(2)标准状况下,若④和⑤混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为
(3)现取一定量的硫酸酸化的硫酸锰(
| 加入物质 | ①适量铋酸钠 | ②过量的双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
已知:①金属铋(Bi)价态为+3时较稳定,
②铋酸钠(
③淀粉溶液遇到
由上述现象可得
(4)实验室用胆矾配制100mL
①以下操作会引起所配制溶液浓度偏低的是
a.容量瓶底部有少量水
b.胆矾溶于水后立即转移到容量瓶中
c.定容时仰视刻度线
d.胆矾长期放置失去部分结晶水
②现利用上述
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

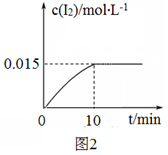
 AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。



