填空题 较难0.4 引用1 组卷292
一定条件下,在一容积为4 L的密闭容器中通入0.4 molN2和1.2 molH2,发生反应:N2(g)+3H2(g)  2NH3(g) △H<0;
2NH3(g) △H<0;
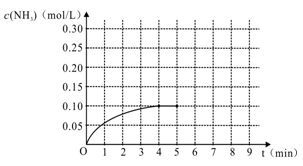
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_____________ (注明单位)。
(2)该条件下,反应的平衡常数表达式K =_________ ,若降低温度,K值将_____ (填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将_____ 移动(“向逆反应方向”、“向正反应方向”或“不”).
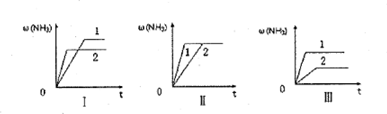
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是__ 。

a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
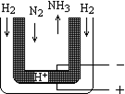
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为____________________ 。
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=
(2)该条件下,反应的平衡常数表达式K =
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是

a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为

14-15高三下·广东惠州·阶段练习
类题推荐
氨在国民生产中占有重要的地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
根据表中数据计算:
(1)反应进行到2小时时放出的热量为____________ kJ。
(2)此条件下该反应的化学平衡常数K=____________ (保留两位小数)。
(3)有两个密闭容器A和B,A容器保持恒容,B容器保持恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g) 3H2(g)+N2(g)。则:
3H2(g)+N2(g)。则:
①达到平衡所需的时间:t(A)_____ t(B),平衡时,NH3的转化率:a(A)______ a(B) (填“>”、“=”或“<”)。
②达到平衡后,在两容器中分别通入等量的氦气。A中平衡向_________ 移动,B中平衡向_________ 移动。(填“向正反应方向”、“向逆反应方向”、“不”)。
(4)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数[φ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是_____ (填字母,下同)。
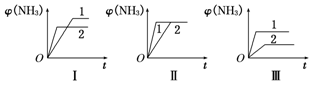
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
 2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
(1)反应进行到2小时时放出的热量为
(2)此条件下该反应的化学平衡常数K=
(3)有两个密闭容器A和B,A容器保持恒容,B容器保持恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)
 3H2(g)+N2(g)。则:
3H2(g)+N2(g)。则:①达到平衡所需的时间:t(A)
②达到平衡后,在两容器中分别通入等量的氦气。A中平衡向
(4)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数[φ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是

A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题: