解答题-实验探究题 适中0.65 引用2 组卷308
某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
合成反应:
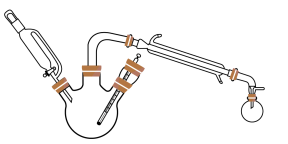
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
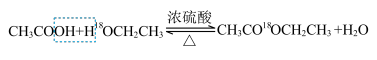
(1)酯化反应的机理
用乙醇羟基氧示踪
用醋酸羟基氧示踪
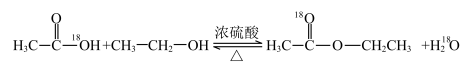
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理______________________ 。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=__________________ 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
(4)浓硫酸与乙醇如何混合?__________________ 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?_______________ 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?_____________________ 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净?________________ 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?_________________ 。

CH3COOH + C2H5OH
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | 76.5 | 不溶 |
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪

用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
| A.立即补加 | B.冷却后补加 | C.不需补加 | D.重新配料 |
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?
2015·宁夏银川·一模
类题推荐
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
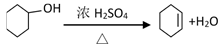
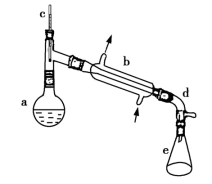
可能用到的有关数据如下:
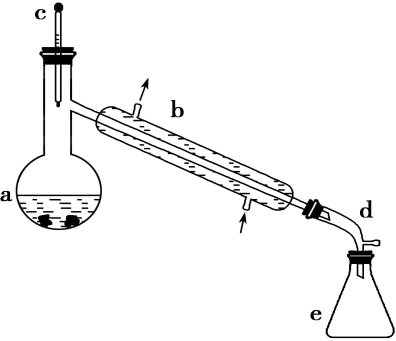
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是_______ ,装置a的名称是___________ ,
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______ 。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______ 。
(4)分离提纯过程中加入无水氯化钙的目的是___________ 。
(5)本实验所得到的环己烯产率是__________ (填正确答案标号)。
A.41% B.52% C.61% D.70%

可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
(4)分离提纯过程中加入无水氯化钙的目的是
(5)本实验所得到的环己烯产率是
A.41% B.52% C.61% D.70%
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
 + H2O
+ H2O
可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是__ 。
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是__ 。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__ 。
(4)分离提纯过程中加入无水氯化钙的目的是__ 。
(5)本实验所得到的环己烯产率是__ (填正确答案标号)。
A.41% B.50% C.61% D.70%
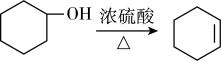 + H2O
+ H2O
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
(4)分离提纯过程中加入无水氯化钙的目的是
(5)本实验所得到的环己烯产率是
A.41% B.50% C.61% D.70%
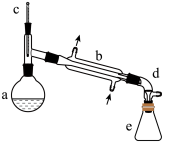
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


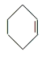 +H2O
+H2O
可能用到的有关数据如下:
合成反应:在 a 中加入 20 g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓 H2SO4,b中通入冷却水后,开始缓慢加热 a,控制馏出物的温度不超过 90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量 5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯 10 g。
回答下列问题:
(1)装置 a 的名称是___________ 。
(2)实验中为防止暴沸加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___________ 。(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)粗产物倒入分液漏斗中加入少量 5%碳酸钠溶液和水,振荡、静置、分层,环己烯在___________ 层(填上或下),
(4)分离提纯过程中加入无水氯化钙的目的是___________ 。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________ (填正确答案标号)。
A.圆底烧瓶B.温度计C.分液漏斗D.球形冷凝管E.接收器
(6)合成过程中加入浓硫酸的作用是___________ 。
(7)环己烯的产率___________ 。(保留两位有效数字)


 +H2O
+H2O可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量 5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯 10 g。
回答下列问题:
(1)装置 a 的名称是
(2)实验中为防止暴沸加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)粗产物倒入分液漏斗中加入少量 5%碳酸钠溶液和水,振荡、静置、分层,环己烯在
(4)分离提纯过程中加入无水氯化钙的目的是
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有
A.圆底烧瓶B.温度计C.分液漏斗D.球形冷凝管E.接收器
(6)合成过程中加入浓硫酸的作用是
(7)环己烯的产率
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


