解答题-实验探究题 适中0.65 引用2 组卷258
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
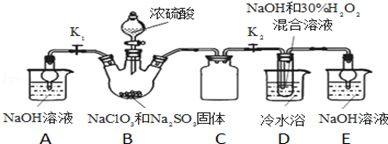
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。

(1)装置③的作用是________________________ ,装置①的作用是________________________
(2)装置②中制备ClO2的化学方程式为____________________ 产生ClO2的还原剂是装置④中制备NaClO2的化学方程式为_____________________________
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③____________ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
(4)达到滴定终点时的现象为______________________________
(5)该样品中NaClO2的质量分数为(用含m、c、V的代数式表示)。______________
(6)在滴定操作正确无误的情况下,此实验测得结果_____________ (填“偏高”或“偏低”),原因用离子方程式表示为_____________________
实验I:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。

(1)装置③的作用是
(2)装置②中制备ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果
15-16高三上·天津南开·阶段练习
类题推荐
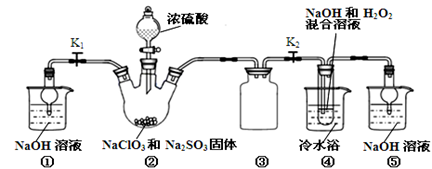
亚氯酸钠(NaClO2)是一种重要的消毒剂和漂白剂。某化学兴趣小组欲利用图示装置制取亚氯酸钠,并进行纯度的测定。

已知:①2NaClO3+Na2SO3+H2SO4→2ClO2↑+2Na2SO4+H2O
②饱和NaClO2溶液析出晶体与温度的关系如表所示。
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
实验一、制备NaClO2晶体
(1)装置A、B中都有的仪器是____ 。
(2)装置A中通入空气的作用是____ 。
(3)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55C蒸发结晶;②____ ;③____ ;④低于60℃干燥,得到成品。(选择合适的操作编号填空)
a.冷却到室温后,过滤 b.趁热过滤 c.常温洗涤 d.38~60℃的温水洗涤
(4)装置B反应后的溶液中含有SO ,原因是
,原因是____ 。
实验二、测定产品纯度
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。
(已知:ClO +4I-+4H+→2H2O+2I2+Cl-、I2+2S2O
+4I-+4H+→2H2O+2I2+Cl-、I2+2S2O →2I-+S4O
→2I-+S4O )
)
(5)达到滴定终点时的现象为____ 。
(6)该样品中NaClO2的质量分数为____ (用含m、c、V的代数式表示)。
(7)若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果____ (填“偏高”“偏低”或“无影响”)。

已知:①2NaClO3+Na2SO3+H2SO4→2ClO2↑+2Na2SO4+H2O
②饱和NaClO2溶液析出晶体与温度的关系如表所示。
| 温度/℃ | <38 | 38~60 | >60 |
| 晶体成分 | NaClO2•3H2O | NaClO2 | NaClO2分解生成NaClO3和NaCl |
实验一、制备NaClO2晶体
(1)装置A、B中都有的仪器是
(2)装置A中通入空气的作用是
(3)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55C蒸发结晶;②
a.冷却到室温后,过滤 b.趁热过滤 c.常温洗涤 d.38~60℃的温水洗涤
(4)装置B反应后的溶液中含有SO
实验二、测定产品纯度
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。
(已知:ClO
(5)达到滴定终点时的现象为
(6)该样品中NaClO2的质量分数为
(7)若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网