填空题 较难0.4 引用2 组卷147
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的碳源危机,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为
CO(g)+3H2(g) △H = +206kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为_______________ 。平衡后可以采取下列______________ 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式________________________________ 。
②该反应的△S______ 0(填>或<或=),在 _________ 情况下有利于该反应自发进行。
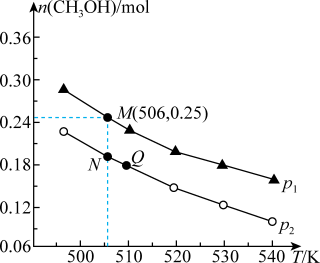
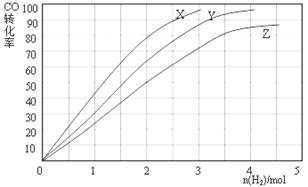
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是_______ (填字母);理由是_________________ 。列式计算270℃时该反应的平衡常数K:__________ 。
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g)
CO2(g)+H2(g)
①试写出由CO和H2制取甲醇的热化学方程式
②该反应的△S
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是

15-16高三上·浙江台州·阶段练习
类题推荐
利用可再生能源代替石油和煤已经成为未来发展的趋势,甲醇作为重要的可再生能源具有广泛的开发和应用前景。工业上常利用反应CO(g)+2H2(g) ⇌CH3OH(g) △H<0来合成甲醇。
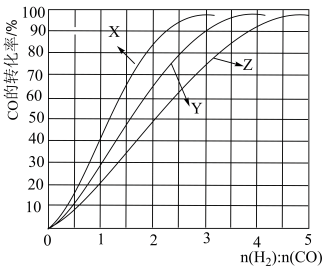
(1)经研究发现在230℃~270℃时合成最为有利。为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图。230℃的实验结果所对应的曲线是_______ (填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是_________ (填字母)。
A.1~1.5 B.2.5~3 C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。回答下列问题:
①该温度下,若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L-1,反应进行一段时间后,测得CO的浓度为1mol·L-1,则此时该反应v(正)____ v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将_____ (填“增大”、“减小”或“不变”)。
(3)甲醇是一种化工原料,工业上合成甲醇的反CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8kJ·mol—1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①容器内压强P:P甲、P乙与P丙的关系是_____________ (用“>”、“<”或“=”表示);
②变化的热量数值Q中, Q1与Q2的和是___________ (填具体数值)。
(1)经研究发现在230℃~270℃时合成最为有利。为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图。230℃的实验结果所对应的曲线是
A.1~1.5 B.2.5~3 C.3.5~4.5

(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。回答下列问题:
①该温度下,若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L-1,反应进行一段时间后,测得CO的浓度为1mol·L-1,则此时该反应v(正)
②若降低温度,该反应的K值将
(3)甲醇是一种化工原料,工业上合成甲醇的反CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8kJ·mol—1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
②变化的热量数值Q中, Q1与Q2的和是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网