解答题-工业流程题 0.4 引用1 组卷166
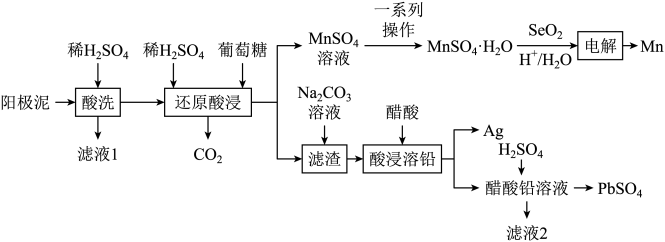
一种回收锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)中金属元素锌、锰、铅和银的工艺如图所示。
(1)Pb2Mn8O16中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为_______ 。
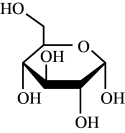
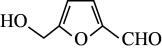
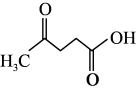
(2)滤液1中主要溶质的化学式为_______ ,“还原酸浸”过程中主要反应的离子方程式为_______ ,实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_______ 。
(3)“电解”时,加入SeO2与水反应生成二元弱酸H2SeO3,在阴极放电生成Se单质,有利于Mn2+电还原沉积,则H2SeO3放电的电极反应式为_______ 。
(4)整个流程中可循环利用的物质是_______ (写名称)。
(5)通过计算说明可用Na2CO3溶液将“滤渣”中的PbSO4转化为PbCO3的原因_______ 。[已知:25℃时Ksp(PbSO4)=2.5×10-8,Ksp(PbCO3)=7.5×10-14]
 +HCOOH
+HCOOH
(1)Pb2Mn8O16中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
(2)滤液1中主要溶质的化学式为
(3)“电解”时,加入SeO2与水反应生成二元弱酸H2SeO3,在阴极放电生成Se单质,有利于Mn2+电还原沉积,则H2SeO3放电的电极反应式为
(4)整个流程中可循环利用的物质是
(5)通过计算说明可用Na2CO3溶液将“滤渣”中的PbSO4转化为PbCO3的原因
23-24高三下·辽宁大连·阶段练习


