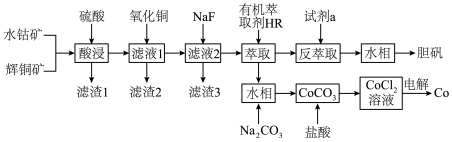
解答题-工业流程题 适中0.65 引用3 组卷42
以水钴矿( ,含
,含 、MgO、CaO)和辉铜矿(
、MgO、CaO)和辉铜矿( ,含
,含 、
、 )为原料制取胆矾和单质钴。
)为原料制取胆矾和单质钴。 ,
, ,
, ;
;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取 的反应原理;
的反应原理; ;
;
④Mg、Ca、Fe、Co均能与强酸反应产生 。
。
回答下列问题:
(1)基态Co原子的简化电子排布式为___________ 。
(2)“酸浸”过程硫元素价态变为 价,写出“酸浸”过程中主要反应的化学方程式:
价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(3)“滤渣1”的主要成分为___________ 。
(4)常温下,若“滤液2”中 (忽略溶液中极少量的
(忽略溶液中极少量的 ),除去2L“滤液2”中的
),除去2L“滤液2”中的 ,至少需加入NaF固体的质量为
,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解 溶液﹑在无离子交换膜的条件下,不能用
溶液﹑在无离子交换膜的条件下,不能用 溶液代替
溶液代替 溶液的理由是
溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入 至弱酸性,生成白色沉淀和硫酸铵。经仪器分析:白色沉淀含H、N、O、S、Cu五种元素;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为一种三角锥形和一种正四面体形。则白色沉淀的化学式为
至弱酸性,生成白色沉淀和硫酸铵。经仪器分析:白色沉淀含H、N、O、S、Cu五种元素;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为一种三角锥形和一种正四面体形。则白色沉淀的化学式为___________ 。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | ||||
| 开始沉淀时 | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时 | 3.7 | 9.0 | 9.1 | 6.2 |
④Mg、Ca、Fe、Co均能与强酸反应产生
回答下列问题:
(1)基态Co原子的简化电子排布式为
(2)“酸浸”过程硫元素价态变为
(3)“滤渣1”的主要成分为
(4)常温下,若“滤液2”中
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入
2024·湖北武汉·二模
类题推荐
钴是一种十分稀缺的金属,素有“工业味精”和“工业牙齿”之称。水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:

已知:①氧化性:Co3+>ClO->Fe3+,酸性条件下,ClO-和Mn2+几乎不反应。
②部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
请回答下列问题:
(1)基态Co子的价层电子排布式为___________ 。
(2)“还原酸浸”中,CoOOH发生反应的化学方程式是___________ 。浸出液中加入NaClO溶液的目的:___________ 。(用离子方程式表示)
(3)浸出过程中加入Na2CO3调pH的范围是___________ 。
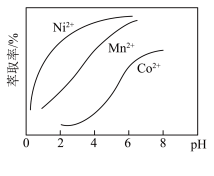
(4)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。使用萃取剂时合适的pH范围为___________(填标号)。
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(6)①钴单质晶体中原子在某温度下的堆积模型如图,若其晶胞几何体的体积是2acm3,钴单质的密度为pg·cm3,已知阿伏加德罗常数为NA,则钴的摩尔质量为___________ 。
a. b.
b. 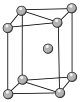 c.
c. 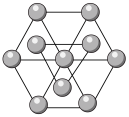
②经X射线衍射测定发现,晶体钴在417℃以上堆积方式发生改变,其剖面图如图所示,则该堆积方式属于___________ ,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为___________ (用含π的代数式表示)。


已知:①氧化性:Co3+>ClO->Fe3+,酸性条件下,ClO-和Mn2+几乎不反应。
②部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
| 沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)基态Co子的价层电子排布式为
(2)“还原酸浸”中,CoOOH发生反应的化学方程式是
(3)浸出过程中加入Na2CO3调pH的范围是
(4)如图所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。使用萃取剂时合适的pH范围为___________(填标号)。

| A.1~2 | B.3~4 | C.6~7 | D.7~8 |
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是
(6)①钴单质晶体中原子在某温度下的堆积模型如图,若其晶胞几何体的体积是2acm3,钴单质的密度为pg·cm3,已知阿伏加德罗常数为NA,则钴的摩尔质量为
a.
 b.
b.  c.
c. 
②经X射线衍射测定发现,晶体钴在417℃以上堆积方式发生改变,其剖面图如图所示,则该堆积方式属于

实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
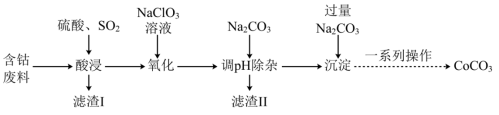
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
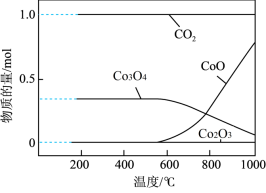
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

回答下列问题:
(1)Fe、Co、Ni是三种重要的金属元素。Fe、Co、Ni都能与 反应,其中Co和Ni均生成二氯化物,由此推断
反应,其中Co和Ni均生成二氯化物,由此推断 、
、 和
和 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。一种钴氧化物晶胞如图所示,该氧化物中钴离子价电子排布式为_______ 。设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______ g﹒cm-3。

(2)以钴矿[主要成分是CoO、 、
、 ,还含
,还含 及少量
及少量 、
、 、CuO及
、CuO及 等]为原料可制取钴的氧化物。利用钴矿制取钴的氧化物的主要步骤如下:
等]为原料可制取钴的氧化物。利用钴矿制取钴的氧化物的主要步骤如下:
①浸取:用盐酸和 溶液浸取钴矿,浸取液中含有
溶液浸取钴矿,浸取液中含有 、
、 、
、 、
、 、
、 、
、 、
、 等离子。写出
等离子。写出 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
②除杂:向浸取液中先加入足量 氧化
氧化 ,再加入NaOH调节pH除去
,再加入NaOH调节pH除去 、
、 、
、 。有关沉淀数据如下表(“完全沉淀”时金属离子浓度
。有关沉淀数据如下表(“完全沉淀”时金属离子浓度 mol·L
mol·L ):
):
若浸取液中 mol·L
mol·L ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是_______ (加入 和NaOH时,溶液的体积变化忽略)。
和NaOH时,溶液的体积变化忽略)。
③萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂 ,发生反应:
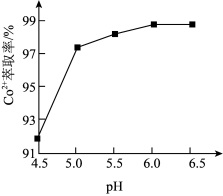
,发生反应:  。实验测得:当溶液pH处于4.5~6.5范围内,
。实验测得:当溶液pH处于4.5~6.5范围内, 萃取率随溶液pH的增大而增大(如下图所示),其原因是
萃取率随溶液pH的增大而增大(如下图所示),其原因是_______ 。向萃取所得有机相中加入 ,反萃取得到水相。
,反萃取得到水相。
④沉钴、热分解:向反萃取后得到的水相中加入 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和
晶体。称取14.64 g该晶体,在空气中加热一段时间后,得到CoO和 的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和
的混合物。称量该混合物,质量为6.32 g,通过计算确定该混合物中CoO和 的质量之比
的质量之比_______ (写出最简整数比)。
(1)Fe、Co、Ni是三种重要的金属元素。Fe、Co、Ni都能与

(2)以钴矿[主要成分是CoO、
①浸取:用盐酸和
②除杂:向浸取液中先加入足量
| 沉淀 | |||||
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 | 6.7 | 10.1 |
若浸取液中
③萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂

④沉钴、热分解:向反萃取后得到的水相中加入
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


