解答题-原理综合题 较难0.4 引用1 组卷63
温室气体 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
Ⅰ. 工业上利用 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为
反应①: CH4(g)+ CO2(g) 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g) CO(g) + H2O (g)
CO(g) + H2O (g) 
反应③:2 CO(g) CO2 (g) + C (s)
CO2 (g) + C (s) 
反应④:CH4(g) 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
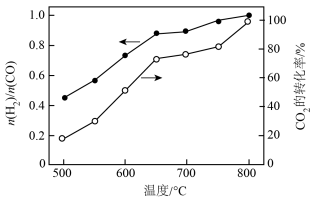
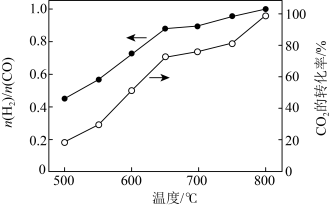
将 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
_______ 。
(2)500℃时, 比较小,此时发生的副反应以
比较小,此时发生的副反应以_______ (选填②、③、④中一种)为主。升高温度,产物中 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是_______ 。
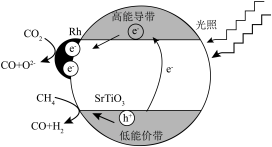
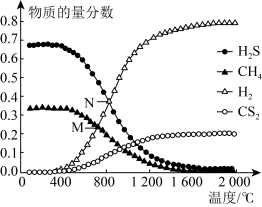
Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:_______ 。
(4)N点对应温度下,该反应的KP =_______ (MPa)2 (保留两位有效数字)
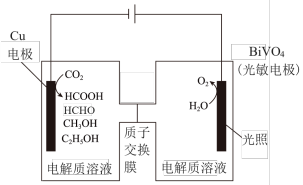
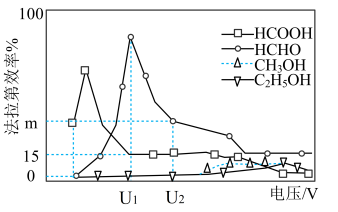
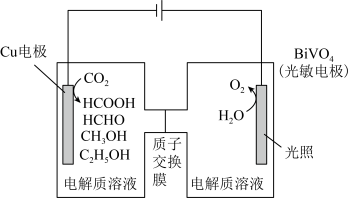
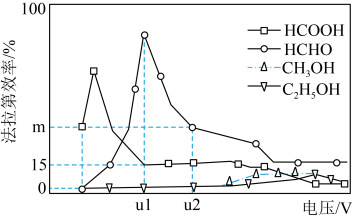
Ⅲ.用光电化学法将 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
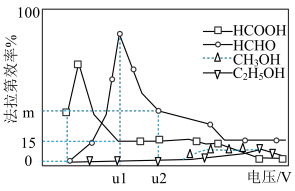
(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为_______ 。
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为_______ 。
Ⅰ. 工业上利用
反应①: CH4(g)+ CO2(g)
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g)
反应③:2 CO(g)
反应④:CH4(g)
将
(2)500℃时,
Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g)
(4)N点对应温度下,该反应的KP =
Ⅲ.用光电化学法将
(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为
2024·宁夏银川·三模
类题推荐
I.近年来,碳中和、碳达峰成为热点。以( 2
2 2为原料生产甲醇是一种有效利用二氧化碳的途径。涉及的反应有
2为原料生产甲醇是一种有效利用二氧化碳的途径。涉及的反应有
I. CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H1<0
Ⅱ. CO(g)+2H2(g)⇌CH3OH(g) ∆H2<0
Ⅲ. CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H3>0
(1)关于反应I,下列描述正确的是_______(填字母序号)。
(2)若某反应的平衡常数表达式为 根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:
根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:_______ 。
(3)工业中,对于反应I,通常同时存在副反应IV 在一定条件下,在合成塔中充入一定量
在一定条件下,在合成塔中充入一定量 2和
2和 2。不同压强时,
2。不同压强时, 2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
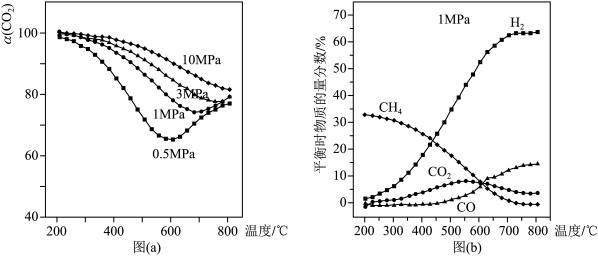
①图a中,相同温度下,压强越大, 2的平衡转化率越大,其原因是
2的平衡转化率越大,其原因是_______ 。
②由图b可知,△H4_______ 0(填“>”、“<”或“=”)。
(4)在一定条件下(温度为 往恒容密闭容器中充入
往恒容密闭容器中充入 2和
2和 2,发生反应I,初始压强为P₀,5min达到平衡,压强为(
2,发生反应I,初始压强为P₀,5min达到平衡,压强为( 则
则 2的平衡转化率为
2的平衡转化率为_______ 。
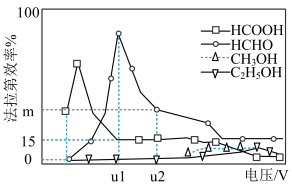
II.近年,科学家发现,可用光电化学法将( 2还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
2还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:

 其中,
其中, n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(5)当电解电压为ulV时,阴极生成HCHO的电极反应式为_______ 。
(6)当电解电压为u2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则图中生成HCHO的法拉第效率为_______ 。
I. CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ∆H1<0
Ⅱ. CO(g)+2H2(g)⇌CH3OH(g) ∆H2<0
Ⅲ. CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H3>0
(1)关于反应I,下列描述正确的是_______(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时, |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
(2)若某反应的平衡常数表达式为
(3)工业中,对于反应I,通常同时存在副反应IV

①图a中,相同温度下,压强越大,
②由图b可知,△H4
(4)在一定条件下(温度为
II.近年,科学家发现,可用光电化学法将(


(5)当电解电压为ulV时,阴极生成HCHO的电极反应式为
(6)当电解电压为u2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则图中生成HCHO的法拉第效率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网