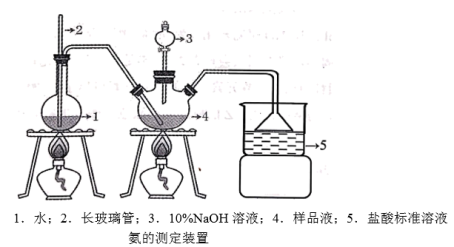
解答题-实验探究题 适中0.65 引用1 组卷54
一水合硫酸四氨合铜 为蓝色正交晶体,在工业上用途广泛,主要用于印染、电镀、纤维、杀虫剂的制备和制备某些含铜的化合物。常温下,一水合硫酸四氨合铜(Ⅱ)易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末。其制备方法如下:
为蓝色正交晶体,在工业上用途广泛,主要用于印染、电镀、纤维、杀虫剂的制备和制备某些含铜的化合物。常温下,一水合硫酸四氨合铜(Ⅱ)易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末。其制备方法如下:
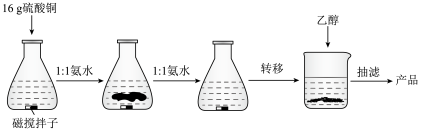
①向一只锥形瓶中加入约50mL水,放置于磁力搅拌器上,速度调节为中速。
②将16g无水硫酸铜晶体缓慢地加入锥形瓶中,同时加入3~5mL稀硫酸。当硫酸铜晶体在常温下不再溶解时即可停止加入硫酸铜,如仍有部分硫酸铜晶体未溶就微热促使硫酸铜溶解。此时溶液呈淡蓝色。关闭磁力搅拌器,取下锥形瓶。
③向上一步的溶液中缓慢加入1:1氨水。可观察到先出现淡蓝色沉淀,随着氨水的增多,上层出现一深蓝色液层,沉淀部分溶解。滴加氨水直到之前的蓝色沉淀完全溶解,再加氨水稍过量3~5mL即可。此时溶液呈深蓝色,较为不透光。
④摇匀后抽滤使溶液中不含不溶物,得到的溶液倒入烧杯。
⑤向上一步的溶液中缓慢加入乙醇,观察到开始有部分深蓝色晶体沉积在杯壁上。加乙醇直到晶体完全沉降。盖上表面血静置15min。此时杯壁上沉积着大量 晶体。倾析法除去大部分乙醇。进行抽滤。
晶体。倾析法除去大部分乙醇。进行抽滤。
⑥用氨水:乙醇=1:2的溶液洗涤所得产品,之后再一次用95%乙醇清洗产品。抽滤至干燥,得产品20g。
(1)步骤②中,溶解 固体的过程中,加入稀硫酸的目的是
固体的过程中,加入稀硫酸的目的是_______ 。
(2)步骤③中,加入1:1氨水产生深蓝色溶液的过程,发生反应的化学方程式为_______ 。说明H2O与Cu2+结合的稳定程度小于NH3,试从结构的角度进行解释:_______ 。
(3)步骤⑤中,加乙醇析出深蓝色溶液的原因是_______ 。
(4)抽滤所得母液中, 受热易分解,从中回收乙醇可采取的方式是
受热易分解,从中回收乙醇可采取的方式是_______ 。
(5)若将生成的四氨合铜离子中的两个NH3换成Cl-,则存在顺式和反式两种不同的立体异构体,则四氨合铜离子的空间结构应为_______ 形。
(6)过滤操作的主要目的是将固液混合物进行分离。中学化学中常见的用于固液混合物分离的操作有“普通过滤”和“减压过滤”等,操作示意图如下:
(7)该实验过程的产率为_______ (保留三位有效数字)。
①向一只锥形瓶中加入约50mL水,放置于磁力搅拌器上,速度调节为中速。
②将16g无水硫酸铜晶体缓慢地加入锥形瓶中,同时加入3~5mL稀硫酸。当硫酸铜晶体在常温下不再溶解时即可停止加入硫酸铜,如仍有部分硫酸铜晶体未溶就微热促使硫酸铜溶解。此时溶液呈淡蓝色。关闭磁力搅拌器,取下锥形瓶。
③向上一步的溶液中缓慢加入1:1氨水。可观察到先出现淡蓝色沉淀,随着氨水的增多,上层出现一深蓝色液层,沉淀部分溶解。滴加氨水直到之前的蓝色沉淀完全溶解,再加氨水稍过量3~5mL即可。此时溶液呈深蓝色,较为不透光。
④摇匀后抽滤使溶液中不含不溶物,得到的溶液倒入烧杯。
⑤向上一步的溶液中缓慢加入乙醇,观察到开始有部分深蓝色晶体沉积在杯壁上。加乙醇直到晶体完全沉降。盖上表面血静置15min。此时杯壁上沉积着大量
⑥用氨水:乙醇=1:2的溶液洗涤所得产品,之后再一次用95%乙醇清洗产品。抽滤至干燥,得产品20g。
(1)步骤②中,溶解
(2)步骤③中,加入1:1氨水产生深蓝色溶液的过程,发生反应的化学方程式为
(3)步骤⑤中,加乙醇析出深蓝色溶液的原因是
(4)抽滤所得母液中,
(5)若将生成的四氨合铜离子中的两个NH3换成Cl-,则存在顺式和反式两种不同的立体异构体,则四氨合铜离子的空间结构应为
(6)过滤操作的主要目的是将固液混合物进行分离。中学化学中常见的用于固液混合物分离的操作有“普通过滤”和“减压过滤”等,操作示意图如下:

| A.过滤速度相对较快 | B.能过滤胶状混合物 |
| C.得到的固体物质相对比较干燥 | D.可使沉淀中的杂质减少 |
(7)该实验过程的产率为
2024·湖南·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网