解答题-实验探究题 适中0.65 引用1 组卷41
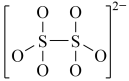
连二亚硫酸钠( )在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定,低于52℃时
)在空气中极易被氧化,不溶于乙醇,在碱性介质中较稳定,低于52℃时 在水溶液中以
在水溶液中以 形态结晶,高于52℃时
形态结晶,高于52℃时 在碱性溶液中脱水成无水盐。实验室制备
在碱性溶液中脱水成无水盐。实验室制备 的原理为
的原理为 (
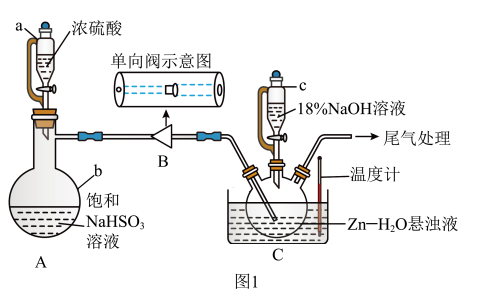
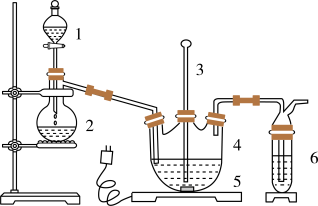
( 易溶于水),实验装置如图1所示(夹持仪器已省略),实验步骤如下:
易溶于水),实验装置如图1所示(夹持仪器已省略),实验步骤如下:
ⅱ.向三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液;
ⅲ.打开仪器a的活塞,向装置C中通入一段时间 ;
;
ⅳ.打开仪器c的活塞,滴加稍过量NaOH溶液,控制pH在8.2~10.5之间[ 呈现两性,pH>10.5时其开始溶解];
呈现两性,pH>10.5时其开始溶解];
ⅴ.过滤,滤液经一系列操作可获得 。
。
回答下列问题:
(1)仪器b的名称是_______ ,该仪器中发生反应的化学方程式为_______ 。
(2)装置B单向阀的作用是_______ ;步骤ⅲ中装置C的水浴温度应控制为35~45℃之间,其原因是_______ 。
(3)下列关于步骤ⅳ的说法错误的是_______(填字母)。
(4)“一系列操作”包括:a.趁热过滤;b.用乙醇洗涤;c.搅拌下用水蒸气加热至60℃左右;d.分批加入细食盐粉,搅拌使其结晶,用倾析法除去上层溶液,余少量母液。上述操作的合理顺序为_______ →干燥(填字母)。
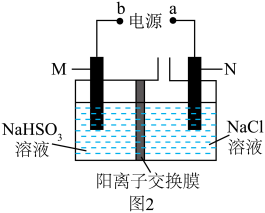
(5)电解法制备 的原理如图2所示,M、N均为惰性电极,充分电解后左池的溶质主要为
的原理如图2所示,M、N均为惰性电极,充分电解后左池的溶质主要为 、NaOH。M极电极反应式为
、NaOH。M极电极反应式为_______ 。 样品纯度的测定(假设杂质不参与反应,实验过程需在氮气氛围中进行):称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加0.1000
样品纯度的测定(假设杂质不参与反应,实验过程需在氮气氛围中进行):称取0.2500g样品加入三颈烧瓶中,加入适量NaOH溶液,打开电磁搅拌器,通过滴定仪控制滴定管向三颈烧瓶中快速滴加0.1000 的
的 标准溶液,达到滴定终点时消耗25.00mL标准溶液{
标准溶液,达到滴定终点时消耗25.00mL标准溶液{ (未配平)}。
(未配平)}。
①该样品的纯度为_______ %。
②若实验过程中未通入 ,则所测
,则所测 的纯度
的纯度_______ (填“偏低”“偏高”或“无影响”)。
ⅱ.向三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成悬浊液;
ⅲ.打开仪器a的活塞,向装置C中通入一段时间
ⅳ.打开仪器c的活塞,滴加稍过量NaOH溶液,控制pH在8.2~10.5之间[
ⅴ.过滤,滤液经一系列操作可获得
回答下列问题:
(1)仪器b的名称是
(2)装置B单向阀的作用是
(3)下列关于步骤ⅳ的说法错误的是_______(填字母)。
| A.pH过大 |
| B.pH过小 |
| C.装置C中18%NaOH溶液应用无氧水配制 |
| D.不可以用碳酸钠溶液代替氢氧化钠溶液 |
(4)“一系列操作”包括:a.趁热过滤;b.用乙醇洗涤;c.搅拌下用水蒸气加热至60℃左右;d.分批加入细食盐粉,搅拌使其结晶,用倾析法除去上层溶液,余少量母液。上述操作的合理顺序为
(5)电解法制备
①该样品的纯度为
②若实验过程中未通入
2024·陕西铜川·模拟预测
类题推荐
连二亚硫酸钠(Na2S2O4,易溶于水、难溶于乙醇、在碱性介质中较稳定、在空气中易被氧化)是重要的化工产品,可用SO2与Zn、NaOH溶液反应制取。
回答下列问题:
I.SO2的制备。实验室可用亚硫酸钠固体与70%的浓硫酸制备二氧化硫。
(1)若要达到控制反应速率的目的,图中可选用的装置是____ (填标号)。
II.Na2S2O4的制备及含量测定。
制备原理为:Zn+2SO2=ZnS2O4、ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2
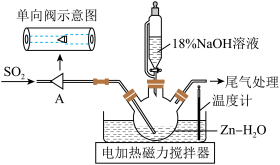
步骤1:安装好整套装置(夹持装置省略),并检查装置的气密性;
步骤2:在三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成颗粒度约为180μm的锌粉与水形成的分散系;
步骤3:向三颈烧瓶内通入一段时间SO2后,打开恒压分液漏斗的活塞滴加稍过量的NaOH溶液使三颈烧瓶中溶液显弱碱性;
步骤4:取三颈烧瓶内溶液加入NaCl固体,经过一系列操作后得到Na2S2O4晶体。
(2)步骤2中分散系为____ (填“溶液”“胶体”或“悬浊液”)。
(3)步骤3先通入一段时间SO2,除了和锌粉反应以外还具有的作用是____ 。需调节溶液为弱碱性的原因为____ 。
(4)步骤4中应选择____ (填洗涤剂名称)洗涤连二亚硫酸钠。
(5)称取上述制得的连二亚硫酸钠样品0.0870g加入另一三颈烧瓶,通过自动电位滴定仪控制滴定管向三颈烧瓶中快速滴加K3[Fe(CN)6]溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗10mL0.2mol•L-1的K3[Fe(CN)6]溶液,则样品中连二亚硫酸钠的百分含量为____ (保留三位有效数字)。
回答下列问题:
I.SO2的制备。实验室可用亚硫酸钠固体与70%的浓硫酸制备二氧化硫。
(1)若要达到控制反应速率的目的,图中可选用的装置是
A. | B. | C. | D. |
II.Na2S2O4的制备及含量测定。
制备原理为:Zn+2SO2=ZnS2O4、ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2

步骤1:安装好整套装置(夹持装置省略),并检查装置的气密性;
步骤2:在三颈烧瓶中依次加入Zn粉和水,电磁搅拌形成颗粒度约为180μm的锌粉与水形成的分散系;
步骤3:向三颈烧瓶内通入一段时间SO2后,打开恒压分液漏斗的活塞滴加稍过量的NaOH溶液使三颈烧瓶中溶液显弱碱性;
步骤4:取三颈烧瓶内溶液加入NaCl固体,经过一系列操作后得到Na2S2O4晶体。
(2)步骤2中分散系为
(3)步骤3先通入一段时间SO2,除了和锌粉反应以外还具有的作用是
(4)步骤4中应选择
(5)称取上述制得的连二亚硫酸钠样品0.0870g加入另一三颈烧瓶,通过自动电位滴定仪控制滴定管向三颈烧瓶中快速滴加K3[Fe(CN)6]溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗10mL0.2mol•L-1的K3[Fe(CN)6]溶液,则样品中连二亚硫酸钠的百分含量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
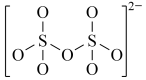
 Na2S2O3
Na2S2O3


