解答题-原理综合题 适中0.65 引用1 组卷225
氢能源是最具应用前景的能源之一。甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法之一,其涉及的主要反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

回答下列问题:
(1)反应Ⅱ能自发进行的条件是_______ 。
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比 充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
充入amolCH4(g)和3amolH2O(g),tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
①下列说法不正确 的是_______ 。
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比 ,有利于提高H2的产率
,有利于提高H2的产率
C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=_______ (用含a,m,n的代数式表示)。
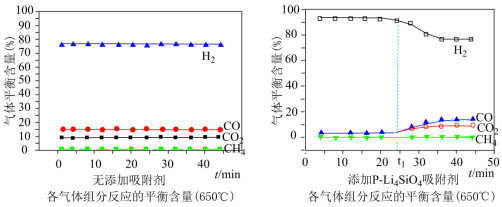
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[ ]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:
]一定时,催化剂中无添加吸附剂和添加P-Li4SiO4吸附((吸收CO2),各气体组分反应的平衡含量与时间的关系如图所示:_______ 。
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是_______ (用化学反应方程式表示)。
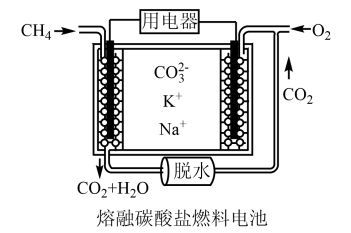
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2: ,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法
,其活化能E((正)<E((逆);过程3:H*在钯膜内的迁移速率是决速步(*表示物质吸附在催化剂表面),下列说法不正确 的是_______。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅱ能自发进行的条件是
(2)一定温度下,向某容积为1L的恒容容器中按照水碳比
①下列说法
A.为防止催化剂中毒和安全事故发生,需对原料气进行脱硫等净化处理
B.提高水碳比
C.其他条件不变,压缩容器体积,反应Ⅱ的平衡不发生移动
D.以Ni/γ-Al2O3作催化剂,降低反应活化能,提高反应速率和原料平衡利用率
②反应Ⅲ的平衡常数K=
(3)650((局部温度过高会造成积碳)、按照一定流速通入原料气,当水碳比[
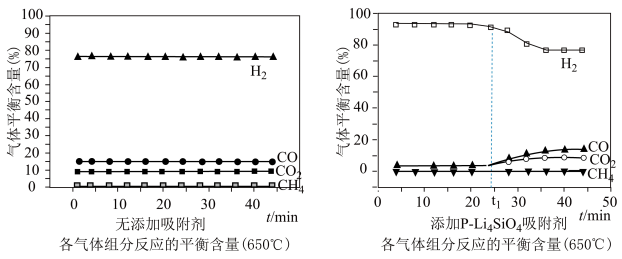
②实验时发现t1min后CO2的平衡含量低于理论平衡值,CO的平衡含量高于理论平衡值,可能的原因是
(4)该反应常采用钯膜分离技(可选择性地让某气体通过而离开体系),其机理如图所示,其中过程2:
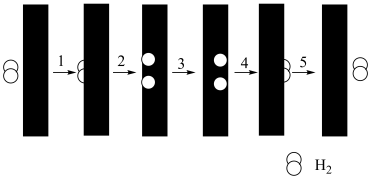
| A.钯膜对H2分子的透过具有选择性 |
| B.过程4的 |
| C.采用钯膜分离技术可以提高原料的利用率 |
| D.常用N2将过程5中的H2吹扫出反应器而促进反应 |
2024·辽宁沈阳·模拟预测
类题推荐
氢气既是一种优质的能源,又是一、种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH4(g) +2H2O(g) CO2(g) +4H2(g) ∆H= +165. 0kJ·mol-1
CO2(g) +4H2(g) ∆H= +165. 0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g) +H2O(g)⇌CO(g) +3H2(g) △H1= +206.4kJ·mol -1
II.CO(g) +H2O(g)⇌CO2(g) +H2(g) △H2
根据上述信息计算:a=______ 、∆H2 =______ 。
(2)某温度下,4molH2O和lmol CH4,在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___ (用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有______ (填标号)。
A.适当增大反应物水与甲烷的投料比 B.提高压强 C.分离出CO2
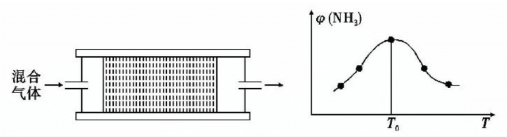
(4)H2用于工业合成氨:N2 +3H2 2NH3 ∆H<0 将n(N2):n(H2) =1:3的混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH;的体积分数φ(NH3)先增大后减小的原因是
2NH3 ∆H<0 将n(N2):n(H2) =1:3的混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH;的体积分数φ(NH3)先增大后减小的原因是______
(5)在Fe催化剂作用下,工业合成NH3的反应历程为:( *表示吸附态)
化学吸附:N2(g)→2N* ; H2(g)→2H* ;
表面反应:N* +H*⇌NH* ;NH* +H*⇌NH2 * ;NH2* +H*⇌NH3*
脱附:NH3 *⇌NH2(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中。常用工艺条件,Fe作催化剂,控制温度773K,压强3.0×105Pa,原料中N2和H2物质的量之比为12. 8。
①分析说明原料气中N2过量的理由______ 、______ 。
②关于合成氨工艺的下列理解,正确的是______ 。
A.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH4(g) +2H2O(g)
已知反应器中存在如下反应过程:
I.CH4(g) +H2O(g)⇌CO(g) +3H2(g) △H1= +206.4kJ·mol -1
II.CO(g) +H2O(g)⇌CO2(g) +H2(g) △H2
| 化学键 | H-H | O-H | C-H | C≡O |
| 键能/kJ·mol-1 | 436 | 465 | a | 1076 |
(2)某温度下,4molH2O和lmol CH4,在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有
A.适当增大反应物水与甲烷的投料比 B.提高压强 C.分离出CO2
(4)H2用于工业合成氨:N2 +3H2

(5)在Fe催化剂作用下,工业合成NH3的反应历程为:( *表示吸附态)
化学吸附:N2(g)→2N* ; H2(g)→2H* ;
表面反应:N* +H*⇌NH* ;NH* +H*⇌NH2 * ;NH2* +H*⇌NH3*
脱附:NH3 *⇌NH2(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。实际生产中。常用工艺条件,Fe作催化剂,控制温度773K,压强3.0×105Pa,原料中N2和H2物质的量之比为12. 8。
①分析说明原料气中N2过量的理由
②关于合成氨工艺的下列理解,正确的是
A.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网