解答题-实验探究题 适中0.65 引用1 组卷183
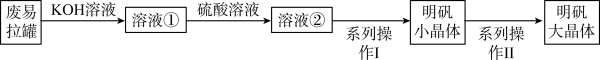
明矾[Ka1(SO4)2·12H2O]在工业上用作净水剂,医药上用作收敛剂。实验小组采用废弃的铝制易拉罐按如下流程制备明矾大晶体。
(1)废铝制易拉罐溶于KOH溶液发生的主要反应为_______ (用离子方程式表示)。
(2)下列说法不正确的是_______。
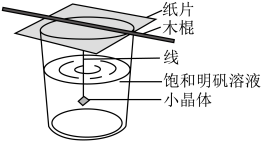
(3)“系列操作Ⅱ”的装置如图所示,烧杯上方所盖的纸片的作用是_______ 。
步骤①:
步骤②:
步骤③:
①NH4F溶液实验室_______ (填“能”或“不能”)盛装在玻璃细口瓶中。
②下列有关说法不正确的是_______ 。
A.天然水体样品中的Ca2+(CaY2-不与F-反应)不影响Al3+含量的测定
B.步骤①所加试剂EDTA,实验前不需要标定其浓度
C.如果步骤②所加Zn2+标准溶液偏少,会导致Al3+浓度的测定值小于真实值
③根据检测过程,请给出配合离子ZnY2-、AlY-、 的稳定性由弱到强的顺序:
的稳定性由弱到强的顺序:_______ 。
④要准确计算水样中Al3+浓度,须利用水样1的体积以及步骤_______ 的实验数据(选填:①、②、③、④)
(1)废铝制易拉罐溶于KOH溶液发生的主要反应为
(2)下列说法不正确的是_______。
| A.可采取将废易拉罐剪碎、酒精灯加热等方式加快溶解速率 |
| B.加入KOH溶液至不再产生气泡后,趁热过滤,除去不溶物 |
| C.“系列操作Ⅰ”有:蒸发浓缩、冷却结晶、过滤、洗涤、灼烧 |
| D.制备明矾大晶体时,小晶体应悬挂在靠近烧杯底部的位置 |
(3)“系列操作Ⅱ”的装置如图所示,烧杯上方所盖的纸片的作用是


步骤①:
步骤②:
步骤③:
①NH4F溶液实验室
②下列有关说法不正确的是
A.天然水体样品中的Ca2+(CaY2-不与F-反应)不影响Al3+含量的测定
B.步骤①所加试剂EDTA,实验前不需要标定其浓度
C.如果步骤②所加Zn2+标准溶液偏少,会导致Al3+浓度的测定值小于真实值
③根据检测过程,请给出配合离子ZnY2-、AlY-、
④要准确计算水样中Al3+浓度,须利用水样1的体积以及步骤
2024·辽宁沈阳·模拟预测
类题推荐
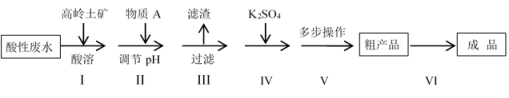
高岭土矿的主要成分是Al2O3、SiO2及少量的Fe2O3,高岭土选矿酸性废水含有大量的H+、SO 、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
相关信息:
①Fe3+、Al3+完全沉淀的pH范围
②有关物质的溶解度
请回答:
(1)步骤I中,要加快高岭土酸溶的速率可以采取的措施有___________ 。(至少写两点),
(2)滤渣的主要成分是___________ 。
(3)下列说法中正确的是___________ 。
A.步骤I的主要目的是提高废水中铝离子的浓度
B.步骤II中的A物质可以是KOH或NaOH
C.步骤II中调节pH的范围是3.2<pH<3.4
D.步骤IV中需调控K2SO4的用量,使n(Al3+):n(K+):n(SO )尽可能接近1:1:2
)尽可能接近1:1:2
(4)步骤VI,为了得到较大颗粒且较干燥的晶体,请从下列选项中选出合理的操作(操作不重复)并排序:取粗产品于烧杯中加适量水→___________→___________→___________→抽滤→洗涤→___________。___________
a.70℃蒸发溶剂制成热的饱和溶液 b.30℃~40℃减压蒸发溶剂得到饱和溶液
c.加热烧杯至晶体完全溶解 d.缓慢冷却至室温 e.低温干燥 f.加热干燥
(5)为了测定成品中铝的含量,可采用的方法:将一定体积的成品待测液与过量的EDTA(化学式为Na2H2Y)标准液反应,加入几滴指示剂,再用ZnSO4标准液滴定过量的EDTA,反应原理如下:Al3++H2Y2-(过量)=AlY-+2H+、Zn2++H2Y2-(剩余)=ZnY2-+2H+(终点色为紫红色),过实验测出成品中铝的含量低于理论值,原因可能是___________ 。
A.制备过程中,由于结晶温度控制不当,溶液中硫酸钾晶体同时析出
B.酸式滴定管用蒸馏水洗净后就注入ZnSO4标准液
C.滴定时锥形瓶溶液出现紫红色,立即停止滴定
D.滴定前,滴定管内无气泡,滴定后有气泡

相关信息:
①Fe3+、Al3+完全沉淀的pH范围
| 沉淀 | Fe(OH)3 | Al(OH)3 | ||
| pH范围 | 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 |
| 2.0 | 3.2 | 3.4 | 4.7 | |
| 温度/℃ 溶解度/g 物质 | 10 | 20 | 30 | 40 | 50 | 70 |
| K2SO4 | 8.46 | 9.55 | 11.4 | 12.9 | 14.2 | 16.7 |
| Al2(SO4)3 | 25.1 | 26.6 | 28.8 | 31.4 | 34.3 | 42.2 |
| KAl(SO4)2•12H2O | 4.0 | 5.9 | 8.4 | 11.7 | 17 | 40 |
(1)步骤I中,要加快高岭土酸溶的速率可以采取的措施有
(2)滤渣的主要成分是
(3)下列说法中正确的是
A.步骤I的主要目的是提高废水中铝离子的浓度
B.步骤II中的A物质可以是KOH或NaOH
C.步骤II中调节pH的范围是3.2<pH<3.4
D.步骤IV中需调控K2SO4的用量,使n(Al3+):n(K+):n(SO
(4)步骤VI,为了得到较大颗粒且较干燥的晶体,请从下列选项中选出合理的操作(操作不重复)并排序:取粗产品于烧杯中加适量水→___________→___________→___________→抽滤→洗涤→___________。
a.70℃蒸发溶剂制成热的饱和溶液 b.30℃~40℃减压蒸发溶剂得到饱和溶液
c.加热烧杯至晶体完全溶解 d.缓慢冷却至室温 e.低温干燥 f.加热干燥
(5)为了测定成品中铝的含量,可采用的方法:将一定体积的成品待测液与过量的EDTA(化学式为Na2H2Y)标准液反应,加入几滴指示剂,再用ZnSO4标准液滴定过量的EDTA,反应原理如下:Al3++H2Y2-(过量)=AlY-+2H+、Zn2++H2Y2-(剩余)=ZnY2-+2H+(终点色为紫红色),过实验测出成品中铝的含量低于理论值,原因可能是
A.制备过程中,由于结晶温度控制不当,溶液中硫酸钾晶体同时析出
B.酸式滴定管用蒸馏水洗净后就注入ZnSO4标准液
C.滴定时锥形瓶溶液出现紫红色,立即停止滴定
D.滴定前,滴定管内无气泡,滴定后有气泡
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网