解答题-原理综合题 较难0.4 引用2 组卷40
近日,厦门大学固体表面物理化学国家重点实验室教授王野、傅钢和中国科学技术大学教授姜政等,创制出超高稳定性In/Rh@S-1催化剂,高选择性催化丙烷等低碳烷烃直接脱氢制取对应烯烃:C3H8(g) C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。
回答下列问题:
(1)已知:几种可燃物的燃烧热如表所示。
上述反应中,△H=______ kJ•mol-1。
(2)一定温度下,在恒容密闭容器中充入1mol丙烷发生上述反应。下列叙述中,正确的是______ (填标号)。
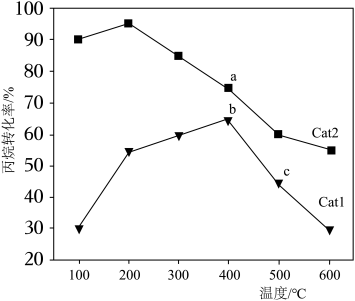
(3)单位时间内,丙烷在不同催化剂Cat1、Cat2作用下的转化率与温度关系如图所示。______ (填“Cat1”或“Cat2”);b点______ (填“是”或“不是”)平衡点;b→c变化的原因可能是______ 。
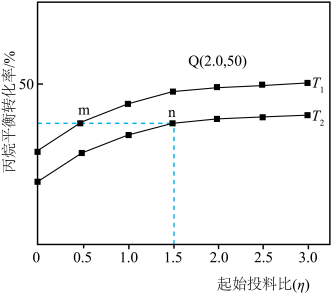
(4)保持总压强恒定为pkPa,向反应器充入丙烷和氩气(Ar)混合气体,仅发生上述反应,丙烷的平衡转化率与温度、起始投料比[η= ]关系如图所示。
]关系如图所示。______ n(填“>”“<”或“=”);T1温度下,压强平衡常数Kp=______ kPa(用含p的代数式表示)。[提示:用分压计算的平衡常数叫做压强平衡常数(Kp),分压=总压×物质的量分数。]
(5)以熔融K2CO3(不含O2-和HCO )为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
)为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为_______ 。为了使电池长时间稳定运行,必须确保电解质组成稳定,即在通入的空气中添加_______ (填化学式)。
回答下列问题:
(1)已知:几种可燃物的燃烧热如表所示。
| 可燃物 | C3H8(g) | C3H6(g) | H2(g) |
| 燃烧热△H/(kJ•mol-1) | -2220 | -2051 | -285.8 |
(2)一定温度下,在恒容密闭容器中充入1mol丙烷发生上述反应。下列叙述中,正确的是
| A.混合气体中H2体积分数最大值为50% |
| B.升高温度,丙烷脱氢反应的平衡常数增大 |
| C.混合气体密度不变时,反应一定达到平衡状态 |
| D.平衡时再充C3H8,丙烷平衡转化率减小 |
(3)单位时间内,丙烷在不同催化剂Cat1、Cat2作用下的转化率与温度关系如图所示。
(4)保持总压强恒定为pkPa,向反应器充入丙烷和氩气(Ar)混合气体,仅发生上述反应,丙烷的平衡转化率与温度、起始投料比[η=
(5)以熔融K2CO3(不含O2-和HCO
2024·湖南衡阳·三模
类题推荐
我国科学家通过修饰催化剂将CO2转化为烃的效率提高了1000倍。在催化剂作用下CO2和H2发生反应 I:4CO2(g) + 13H2(g)  C4H10(g)+8H2O(g) △H1,回答下列问题:
C4H10(g)+8H2O(g) △H1,回答下列问题:
(1)已知C4H10(g)、H2(g)的燃烧热(△H)分别为-2900 KJ﹒mol-1、-285.81 KJ﹒mol-1,H2O(1)=H2O(g) △H4 =+44 KJ﹒mol-1。则 △H1=___________ KJ﹒mol-1。
(2)在恒容恒温条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是___________(填标号)。
(3)在密闭容器中充入一定量的CO2和H2,发生反应I,在催化剂作用下单位时间内CO2的转化率与温度、催化剂的关系如图1所示。
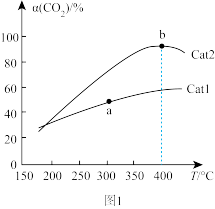
①a点时,C4H10的正反应速率___________ (填“ >”、“ < ”或“ = ”,下同)C4H10的逆反应速率;催化效率: Cat2___________ Cat1。
②b点___________ (填“已达到”、“未达到”或“无法判断是否达到”)化学平衡,理由是___________ ;b点之后CO2的转化率降低,可能的原因是___________ 。
(4)在密闭容器中投入0.4 mol CO2和1.3 mol H2,发生反应I ,测得CO2的平衡转化率与温度、压强的关系如图2所示。
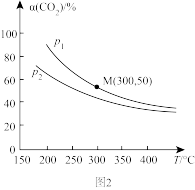
①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是___________ 。
② 已知M点对应的容器体积为1 L,则在对应的温度下,反应I的平衡常数
___________ (只列计算式)。
(1)已知C4H10(g)、H2(g)的燃烧热(△H)分别为-2900 KJ﹒mol-1、-285.81 KJ﹒mol-1,H2O(1)=H2O(g) △H4 =+44 KJ﹒mol-1。则 △H1=
(2)在恒容恒温条件下,向密闭容器中充入CO2、H2,加入合适催化剂,发生反应I,下列情况表明反应I达到平衡状态的是___________(填标号)。
| A.混合气体密度保持不变 |
| B.气体总压强保持不变 |
| C.混合气体的平均摩尔质量保持不变 |
| D.混合气体中C4H10与H2O的物质的量比值不变 |

①a点时,C4H10的正反应速率
②b点
(4)在密闭容器中投入0.4 mol CO2和1.3 mol H2,发生反应I ,测得CO2的平衡转化率与温度、压强的关系如图2所示。

①随着温度升高,不同压强下,CO2的平衡转化率接近相等,原因是
② 已知M点对应的容器体积为1 L,则在对应的温度下,反应I的平衡常数
乙醛(CH3CHO)是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
(1)已知:① ;ΔH1
;ΔH1
② ;ΔH2
;ΔH2
③ ;ΔH3
;ΔH3
 ;ΔH=
;ΔH=___________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量CH3CHO(g)和H2(g)发生反应:下列叙述错误的是___________(填标号)。
(3) 速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
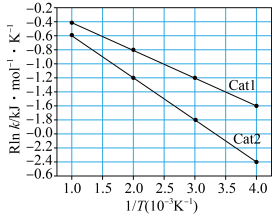
①阿伦尼乌斯就关于速率常数与活化能(Ea)、温度(T)的关系提出经验关系式:Rlnk=- (R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与
(R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与 关系如图所示。催化剂效能较高的是
关系如图所示。催化剂效能较高的是___________ (填“Cat1”或“Cat2”),判断依据是___________ 。 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:
已知:一步进行的反应称为基元反应,基元反应中反应级数等于反应物的化学计量数之和。下列叙述正确的是___________ (填标号)。
A.该总反应为二级反应
B.速率常数k=4.00L·mol-1·s-1
C.上述反应不是基元反应
D.t(CH3CHO)=0.15mol·L-1时v=0.45mol·L-1·s-1
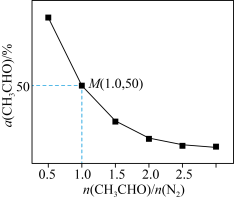
(4)一定温度下,保持总压强为pkPa,向反应器充入CH3CHO(g)和N2的混合气体(N2不参与反应)发生反应 ,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。
,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。___________ 。该温度下,上述反应M点平衡常数Kp=___________ kPa(Kp用分压计算的平衡常数,分压=总压×物质的量分数)。
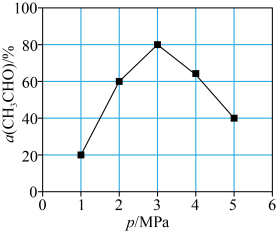
(5)T℃时,向反应器充入一定量CH3CHO(g)发生反应 ,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:
,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:___________ 。
(1)已知:①
②
③
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量CH3CHO(g)和H2(g)发生反应:下列叙述错误的是___________(填标号)。
| A.气体压强不随时间变化时达到平衡状态 |
| B.平衡后充入氖气,平衡向逆反应方向移动 |
| C.上述可逆反应的正反应是熵增反应 |
| D.平衡后,充入少量H2,CH3CHO平衡转化率增大 |
(3)
①阿伦尼乌斯就关于速率常数与活化能(Ea)、温度(T)的关系提出经验关系式:Rlnk=-
| c(CH3CHO)/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 |
| v/mol·L-1·s-1 | 0.020 | 0.080 | 0.182 | 0.318 |
A.该总反应为二级反应
B.速率常数k=4.00L·mol-1·s-1
C.上述反应不是基元反应
D.t(CH3CHO)=0.15mol·L-1时v=0.45mol·L-1·s-1
(4)一定温度下,保持总压强为pkPa,向反应器充入CH3CHO(g)和N2的混合气体(N2不参与反应)发生反应
(5)T℃时,向反应器充入一定量CH3CHO(g)发生反应
我国科学家成功开发Pd—Fe/Fe2O3催化剂在低温条件下高选择性合成高纯度的乙烯,化学原理如下:
主反应:C2H2(g)+H2(g) C2H4(g) △H1
C2H4(g) △H1
副反应:C2H2(g)+2H2(g) C2H6(g) △H2
C2H6(g) △H2
(1)已知:a.几种共价键的键能如下表所示:
b.C2H2(g)、H2(g)、C2H6(g)的燃烧热△H分别为-1299.6kJ·mol-1、-285.8kJ·mol-1、-1559.8kJ·mol-1。
则△H1=_______ kJ·mol-1;乙烯加氢生成乙烷的热化学方程式是_______ 。
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+H2(g) C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
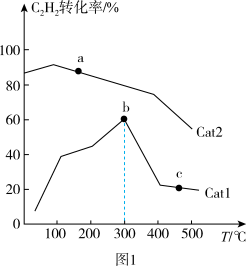
①催化效率较高的是_______ (填“Cat1”或“Cat2”);b点_______ (填“达到”或“未达到”)平衡。
②温度高于300℃,升高温度,b→c的原因可能是_______ (答1条即可)。
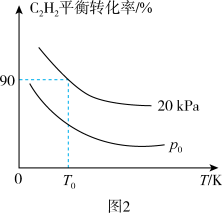
(3)在密闭容器中充入1mol C2H2和2mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图2所示。在T0 K、20kPa下C2H4的选择性等于 [C2H4选择性=
[C2H4选择性= ]。p0
]。p0_______ 20kPa(填“>”、“<”或“=”)。T0 K下,主反应的平衡常数Kp=_______ kPa-1(Kp为用气体分压计算的平衡常数,气体分压等于气体总压×物质的量分数)。
(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2):p(H2)=1:1的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
主反应:C2H2(g)+H2(g)=C2H4(g) k1
副反应:C2H4(g)+H2(g)=C2H6(g) k2
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为_______ ,其理由是_______ 。
主反应:C2H2(g)+H2(g)
副反应:C2H2(g)+2H2(g)
(1)已知:a.几种共价键的键能如下表所示:
| 共价键 | H-C | H-H | C=C | C≡C |
| 键能/(kJ·mol-1) | 413.4 | 436 | 615 | 812 |
则△H1=
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+H2(g)

①催化效率较高的是
②温度高于300℃,升高温度,b→c的原因可能是
(3)在密闭容器中充入1mol C2H2和2mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图2所示。在T0 K、20kPa下C2H4的选择性等于

(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2):p(H2)=1:1的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
主反应:C2H2(g)+H2(g)=C2H4(g) k1
副反应:C2H4(g)+H2(g)=C2H6(g) k2
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


