解答题-实验探究题 较难0.4 引用2 组卷124
四氮化四硫( 为
为 价)为橙黄色固体,易被氧化,难溶于水,易溶于四氯化碳,可用氨气与
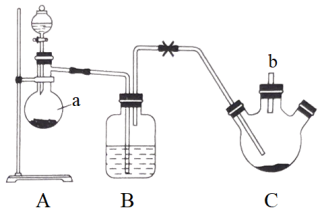
价)为橙黄色固体,易被氧化,难溶于水,易溶于四氯化碳,可用氨气与 反应制备,反应装置如图所示(夹持和加热装置已省略)。
反应制备,反应装置如图所示(夹持和加热装置已省略)。
已知: ;
;
步骤如下: ,打开
,打开 和
和 ,先向装置C中通入干燥纯净的
,先向装置C中通入干燥纯净的 ,待装置C中充满黄绿色气体时,开始加热C,使
,待装置C中充满黄绿色气体时,开始加热C,使 与
与 在
在 下反应生成
下反应生成 ;
;
②待装置C中的 全部反应后,关闭止水夹
全部反应后,关闭止水夹 ,撤掉装置A、B;
,撤掉装置A、B;
③ 处连接制
处连接制 的装置,关闭止水夹
的装置,关闭止水夹 ,打开
,打开 和
和 ,通入干燥纯净的
,通入干燥纯净的 ,反应制得
,反应制得 。
。
回答下列问题:
(1)装置A用 粉末与浓盐酸反应制取
粉末与浓盐酸反应制取 ,发生装置A可以选用
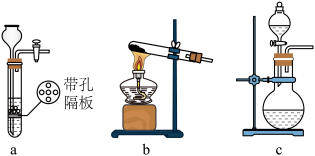
,发生装置A可以选用_________ 。(填选项) 时为使装置C受热均匀,可采用的最佳加热方式为
时为使装置C受热均匀,可采用的最佳加热方式为____________ ;
(3)制取 的同时装置C中还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时装置C中还生成一种常见固体单质和一种盐,写出反应的化学方程式_____________ ;
(4)装置E的作用是____________ 、_________ ;
(5)测定 的纯度:称取
的纯度:称取 样品(杂质不参与反应),加入
样品(杂质不参与反应),加入 溶液,并加热,释放出的氨气用足量
溶液,并加热,释放出的氨气用足量 硼酸吸收[假定溶液体积不变,反应为:
硼酸吸收[假定溶液体积不变,反应为: ].反应后的溶液再用
].反应后的溶液再用 的盐酸进行滴定[滴定反应为:
的盐酸进行滴定[滴定反应为: ],重复三次实验.实验数据记录如下表所示:
],重复三次实验.实验数据记录如下表所示:
____________ .(填选项)
A.滴定时应先快后慢滴入盐酸,且眼睛注视滴定管中液面变化
B.滴加最后半滴方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,使溶液流入锥形瓶,振荡摇匀
C.滴定终点装盐酸的滴定管液面如图所示,则读数为
D.滴定管在滴定前有气泡,滴定后气泡消失,导致测定的结果偏高
②制得的 的纯度为
的纯度为____________ 。(保留四位有效数字)
(6)副产物 溶于水加入硫酸铜溶液中先沉淀后溶解,再向溶解后的深蓝色溶液中加入乙醇后,析出深蓝色晶体,下列叙述正确的是____________.(填选项)
溶于水加入硫酸铜溶液中先沉淀后溶解,再向溶解后的深蓝色溶液中加入乙醇后,析出深蓝色晶体,下列叙述正确的是____________.(填选项)
已知:
步骤如下:

②待装置C中的
③
回答下列问题:
(1)装置A用
(3)制取
(4)装置E的作用是
(5)测定
实验序号 | 初始读数 | 最终读数 |
Ⅰ | 0.20 | 20.42 |
Ⅱ | 0.40 | 24.85 |
Ⅲ | 1.00 | 21.18 |

A.滴定时应先快后慢滴入盐酸,且眼睛注视滴定管中液面变化
B.滴加最后半滴方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,使溶液流入锥形瓶,振荡摇匀
C.滴定终点装盐酸的滴定管液面如图所示,则读数为
D.滴定管在滴定前有气泡,滴定后气泡消失,导致测定的结果偏高
②制得的
(6)副产物
| A.析出的深蓝色晶体为 |
| B.深蓝色晶体中的阴阳离子构型都为正四面体形 |
| C. |
| D.由配体 |
2024·辽宁丹东·二模
类题推荐
已知: 是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与
是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与 反应制得。某同学利用如图装置(加热装置已略)制取
反应制得。某同学利用如图装置(加热装置已略)制取 ,然后制取
,然后制取 。已知:
。已知: 为红棕色液体,有刺激性臭味,熔点:
为红棕色液体,有刺激性臭味,熔点: ,沸点:60℃,易水解。
,沸点:60℃,易水解。

反应步骤:
①反应时先向C中通入干燥的氯气,使硫粉与氯气在50℃下反应生成 。
。
②待C中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉装置A、B。
③连接制氨的装置,通入氨,反应制得 。
。
回答下列问题。
(1)仪器C的名称为_______ ,a中三氧化铬(还原产物中铬为+3价)可与浓盐酸快速反应制得氯气,写出反应的离子方程式_______ 。
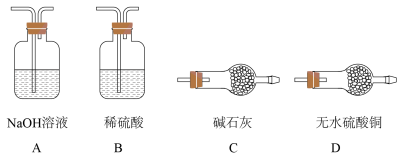
(2)B装置中应选择的试剂为_______ 。制取 过程中,b导管末端应连接下图中的
过程中,b导管末端应连接下图中的_______ (填序号)。
A. B.
B. C.
C.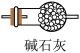 D.
D.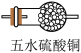
(3)向制得的 中通入
中通入 ,生成
,生成 的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式_______ 。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象_______ 。
(4) 在碱性条件下发生水解反应氮元素转化为氨,用硼酸吸收,滴定氨释放量可进一步测定
在碱性条件下发生水解反应氮元素转化为氨,用硼酸吸收,滴定氨释放量可进一步测定 的纯度。称取1.000g
的纯度。称取1.000g 样品,加入NaOH溶液,并加热,释放出的氨用足量100mL
样品,加入NaOH溶液,并加热,释放出的氨用足量100mL 硼酸吸收[反应方程式为
硼酸吸收[反应方程式为 ,假定反应过程中溶液体积不变]。反应后的溶液以甲基红-亚甲蓝为指示剂,再用
,假定反应过程中溶液体积不变]。反应后的溶液以甲基红-亚甲蓝为指示剂,再用 的盐酸[滴定反应方程式为
的盐酸[滴定反应方程式为
 ]进行滴定,重复三次实验。实验数据记录如下表所示:
]进行滴定,重复三次实验。实验数据记录如下表所示:
则制得的 的纯度为
的纯度为_______ (保留4位有效数字)。

反应步骤:
①反应时先向C中通入干燥的氯气,使硫粉与氯气在50℃下反应生成
②待C中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉装置A、B。
③连接制氨的装置,通入氨,反应制得
回答下列问题。
(1)仪器C的名称为
(2)B装置中应选择的试剂为
A.
 B.
B. C.
C. D.
D.
(3)向制得的
(4)
| 实验序号 | 初始读数 | 最终读数 |
| I | 0.10 | 20.14 |
| II | 0.50 | 24.75 |
| III | 1.00 | 20.96 |
四氮化四硫(S4N4)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于CCl4等有机溶剂,178~187℃熔化并分解,可用NH3与SCl2反应制备,某同学利用如图装置(加热装置已略)制取SCl2,然后制取S4N4。
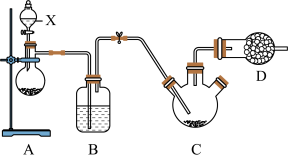
已知:SCl2为红棕色液体,有刺激性臭味,熔点:−78℃,沸点:60℃,易水解。反应步骤如下:
①反应时先向C中通入干燥的氯气,使硫粉与氯气在50℃下反应生成SCl2。
②待C中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉装置A、B。
③连接制氨的装置,通入氨,反应制得S4N4。
回答下列问题:
(1)仪器X的名称为___________ ,装置A中可用三氧化铬(还原产物中铬为+3价)与浓盐酸快速反应制得氯气,写出反应的离子方程式:___________ 。
(2)B装置中应选择的试剂为___________ ,装置D的作用为___________ 。
(3)向制得的SCl2中通入NH3,生成S4N4的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式:___________ 。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象为___________ 。
(4)S4N4在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定S4N4的纯度。称取1.100 g S4N4样品,加入NaOH溶液,并加热,释放出的氨气用足量100 mL1 mol/L硼酸吸收[反应方程式为 ,假定反应过程中溶液体积不变]。反应后的溶液以甲基红―亚甲蓝为指示剂,再用1 mol/L的盐酸[滴定反应方程式为
,假定反应过程中溶液体积不变]。反应后的溶液以甲基红―亚甲蓝为指示剂,再用1 mol/L的盐酸[滴定反应方程式为 ]进行滴定,重复三次实验。实验数据记录如下表所示:
]进行滴定,重复三次实验。实验数据记录如下表所示:
则制得的S4N4的纯度为___________ (保留4位有效数字)。

已知:SCl2为红棕色液体,有刺激性臭味,熔点:−78℃,沸点:60℃,易水解。反应步骤如下:
①反应时先向C中通入干燥的氯气,使硫粉与氯气在50℃下反应生成SCl2。
②待C中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉装置A、B。
③连接制氨的装置,通入氨,反应制得S4N4。
回答下列问题:
(1)仪器X的名称为
(2)B装置中应选择的试剂为
(3)向制得的SCl2中通入NH3,生成S4N4的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式:
(4)S4N4在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定S4N4的纯度。称取1.100 g S4N4样品,加入NaOH溶液,并加热,释放出的氨气用足量100 mL1 mol/L硼酸吸收[反应方程式为
| 实验序号 | 初始读数(mL) | 最终读数(mL) |
| Ⅰ | 0.20 | 20.22 |
| Ⅱ | 0.40 | 24.85 |
| Ⅲ | 1.00 | 20.98 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网