解答题-原理综合题 较难0.4 引用1 组卷72
利用甲烷催化裂解制备乙烯、乙炔,也可以与 在催化剂的作用下合成甲醇,有利于实现碳资源的有效循环。
在催化剂的作用下合成甲醇,有利于实现碳资源的有效循环。
(1)甲烷催化裂解制备乙烯、乙炔时涉及以下反应:
反应I:

反应Ⅱ:

反应Ⅲ:

反应Ⅳ:


_______  。
。
(2)甲烷在固体催化剂表面发生反应I的过程如图所示。_______ ,A到B的能量变化_______ B到C的能量变化(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②某温度下,反应 的
的 、
、 (k为速率常数),部分数据如表所示。
(k为速率常数),部分数据如表所示。
该温度下
_______  ,温度升高,速率常数增大的倍数:
,温度升高,速率常数增大的倍数:
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
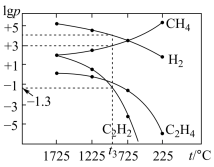
(3)一定条件下,甲烷裂解体系中几种气体的平衡分压的对数与温度的关系如图所示。 时,反应I、Ⅲ中,反应倾向较大的是
时,反应I、Ⅲ中,反应倾向较大的是_______ 。
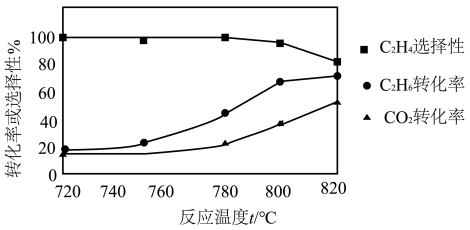
②工业上催化裂解甲烷常通入一定量的 ,原因是
,原因是_______ 。
(4)在催化剂的作用下,利用 与
与 合成甲醇。
合成甲醇。
主反应:
副反应:
在温度为 、压强为
、压强为 下,向容器中充入
下,向容器中充入 、
、 和
和 ,充分反应达平衡时
,充分反应达平衡时 的转化率为
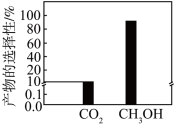
的转化率为 ,产物的选择性[如甲醇的选择性
,产物的选择性[如甲醇的选择性 ]如图所示:
]如图所示: 的物质的量为
的物质的量为_______  。副反应的相对压力平衡常数
。副反应的相对压力平衡常数
_______ (已知:气体的相对分压等于其分压除以标准压强 ,相对压力平衡常数
,相对压力平衡常数 是指用相对分压代替浓度计算的平衡常数)。
是指用相对分压代替浓度计算的平衡常数)。
(1)甲烷催化裂解制备乙烯、乙炔时涉及以下反应:
反应I:
反应Ⅱ:
反应Ⅲ:
反应Ⅳ:
(2)甲烷在固体催化剂表面发生反应I的过程如图所示。

②某温度下,反应
| 0.05 | 4.8 | |
| 19.2 | ||
| 0.15 | 8.1 |
(3)一定条件下,甲烷裂解体系中几种气体的平衡分压的对数与温度的关系如图所示。
②工业上催化裂解甲烷常通入一定量的
(4)在催化剂的作用下,利用
主反应:
副反应:
在温度为
2024·陕西榆林·模拟预测
类题推荐
甲烷催化裂解制备乙烯、乙炔时涉及以下反应:
反应I:2CH4(g) C2H2(g)+3H2(g)△H1=+376.4kJ•mol-1
C2H2(g)+3H2(g)△H1=+376.4kJ•mol-1
反应II:C2H2(g)+H2(g) C2H4(g)△H2=-174.4kJ•mol-1
C2H4(g)△H2=-174.4kJ•mol-1
反应III:CH4(g) C(s)+2H2(g)△H3=+74.8kJ•mol-1
C(s)+2H2(g)△H3=+74.8kJ•mol-1
反应IV:2CH4(g) C2H4(g)+2H2(g)△H4
C2H4(g)+2H2(g)△H4
(1)△H4=_______ 。
(2)甲烷在固体催化剂表面发生反应I的过程如图所示。
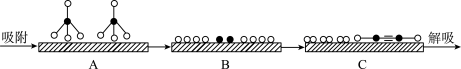
①A、B、C中,能量状态最高的是______ 。
②某温度下,反应I的v正=k正•p2(CH4)、v逆=k逆•p(C2H2)•p3(H2),(k为速率常数),部分数据如表所示。
表中p2=______ ,该温度下k逆=______ MPa-3•min-1;温度开高,速率常数增大的倍数:k正______ k逆(填“>”“<”或“=”)。
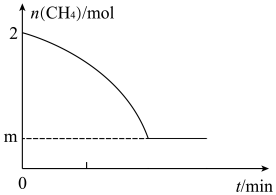
(3)某温度下,向恒容密闭容器中充入一定量CH4(此时压强为p0),仅发生反应IV。
①测得平衡时p(H2):p(CH4)=2:1,CH4的平衡转化率为_______ (保留2位有效数字),反应IV的Kp=_______ 。
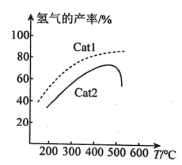
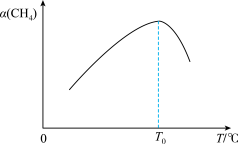
②若升高反应体系温度,在相同时间内测得甲烷的转化率与温度的关系如图所示。T0℃之后甲烷转化率减小的原因是_______ 。
(4)一定条件下,甲烷裂解体系中几种气体的平衡分压的对数与温度的关系如图所示。
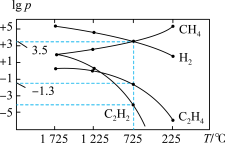
①725℃时,反应I、III中,反应倾向较大的是______ 。
②工业上催化裂解甲烷常通入一定量的H2,原因是______ 。
反应I:2CH4(g)
反应II:C2H2(g)+H2(g)
反应III:CH4(g)
反应IV:2CH4(g)
(1)△H4=
(2)甲烷在固体催化剂表面发生反应I的过程如图所示。

①A、B、C中,能量状态最高的是
②某温度下,反应I的v正=k正•p2(CH4)、v逆=k逆•p(C2H2)•p3(H2),(k为速率常数),部分数据如表所示。
| p(C2H2)/MPa | p(H2)/MPa | v逆/(MPa•min-1) |
| 0.05 | p1 | 4.8 |
| p2 | p1 | 19.2 |
| p2 | 0.15 | 8.1 |
(3)某温度下,向恒容密闭容器中充入一定量CH4(此时压强为p0),仅发生反应IV。
①测得平衡时p(H2):p(CH4)=2:1,CH4的平衡转化率为
②若升高反应体系温度,在相同时间内测得甲烷的转化率与温度的关系如图所示。T0℃之后甲烷转化率减小的原因是

(4)一定条件下,甲烷裂解体系中几种气体的平衡分压的对数与温度的关系如图所示。

①725℃时,反应I、III中,反应倾向较大的是
②工业上催化裂解甲烷常通入一定量的H2,原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
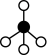 、
、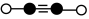 、
、 和
和 表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应Ⅲ,从吸附到解吸的过程中,能量状态最低的是
表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应Ⅲ,从吸附到解吸的过程中,能量状态最低的是