解答题-原理综合题 较难0.4 引用1 组卷78
氮、砷及其化合物在工农业生产等方面有着重要应用。回答下列问题:
(1)氮氧化物( )是常见的大气污染气体之一,用
)是常见的大气污染气体之一,用 催化还原
催化还原 可消除氮氧化物的污染。
可消除氮氧化物的污染。
已知:
①
 ;
;
②
 ;
;
③适量的 和
和 完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
则

___________  。
。
(2)基态砷原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为___________ 。(已知:d轨道电子云轮廓图呈花瓣形。)
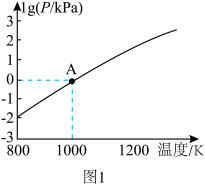
(3)在恒容密闭容器中, 分解反应:
分解反应: 达平衡时,气体总压的对数值
达平衡时,气体总压的对数值 与温度的关系如图1所示。
与温度的关系如图1所示。___________ (填“增大”“减小”或“不变”)。
②A点对应温度下的
___________  (用分数表示)。
(用分数表示)。
(4)25℃时,向0.1 三元弱酸
三元弱酸 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 、
、 、
、 及
及 的物质的量分布分数随pH的变化如图2所示。
的物质的量分布分数随pH的变化如图2所示。___________ 。
②反应 的平衡常数
的平衡常数
___________ 。
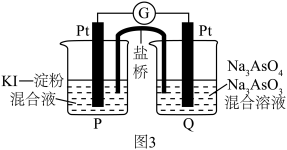
(5)某原电池装置如图3所示,电池总反应为 。当P池中溶液由无色变蓝色时,正极上的电极反应式为
。当P池中溶液由无色变蓝色时,正极上的电极反应式为___________ ;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___________ 。
(1)氮氧化物(
已知:
①
②
③适量的
则
(2)基态砷原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为
(3)在恒容密闭容器中,
②A点对应温度下的
(4)25℃时,向0.1

②反应
(5)某原电池装置如图3所示,电池总反应为
2024·安徽·三模
类题推荐
(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________ 。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的
是___________ 。
A.①>②>③B.③>①>②C.②>③>①D.③>②>①
(3)用铂电极电解一定浓度的下列物质的水溶液,在电解后的溶液中加适量水,能使溶液浓度恢复到电解前浓度的是___________ 。
A.NaOHB.CuSO4C.K2SD.NaCl
(4)比较填空(选填“>"或“ <"或"=”)
①2H2(g)+O2(g)= 2H2O(g)△H1和2H2(g)+O2(g)= 2H2O(l)△H2的△H大小:△H1__________ △H2。
②等体积等PH的溶液:a.盐酸 b.硫酸,分别与足量NaOH溶液反应,消耗NaOH的物质的
量多少:a___________ b。
③常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a__________ b。
④已知某可逆反应aA(g)+bB(g) cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b______ c+d。

(5)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g) CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
回答下列问题:
①该反应的化学平衡常数表达式为K=__________________________ 。
②反应为___________ 反应(填“吸热”或“放热”)。
③某温度下,平衡时各物质的浓度有如下关系:3[c(CO2)•c(H2)] =5[c(CO)•(H2O)],判断此时的反应温度为___________ ℃。
④800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正___________ v逆(填“>"或“<”或“=”)
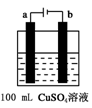
(6)下图所示为用惰性电极电解100mL 0.5mol·CuSO4溶液的装置,b电极上的电极反应式为______ 。若a电极共产生56mL(标准状况)气体,则所得溶液的pH =___________ (不考虑溶液体积变化)。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的
是
A.①>②>③B.③>①>②C.②>③>①D.③>②>①
(3)用铂电极电解一定浓度的下列物质的水溶液,在电解后的溶液中加适量水,能使溶液浓度恢复到电解前浓度的是
A.NaOHB.CuSO4C.K2SD.NaCl
(4)比较填空(选填“>"或“ <"或"=”)
①2H2(g)+O2(g)= 2H2O(g)△H1和2H2(g)+O2(g)= 2H2O(l)△H2的△H大小:△H1
②等体积等PH的溶液:a.盐酸 b.硫酸,分别与足量NaOH溶液反应,消耗NaOH的物质的
量多少:a
③常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a
④已知某可逆反应aA(g)+bB(g)
 cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b
(5)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g)
 CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=
②反应为
③某温度下,平衡时各物质的浓度有如下关系:3[c(CO2)•c(H2)] =5[c(CO)•(H2O)],判断此时的反应温度为
④800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正
(6)下图所示为用惰性电极电解100mL 0.5mol·CuSO4溶液的装置,b电极上的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网