解答题-原理综合题 较难0.4 引用1 组卷26
随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应(DRM)可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为 、
、 和
和 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:___________ 。
(2)甲烷干重整过程中可能存在反应:
R1: (主反应)
(主反应)
R2:
R3:
R4:
R5:
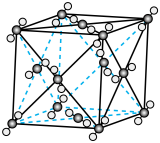
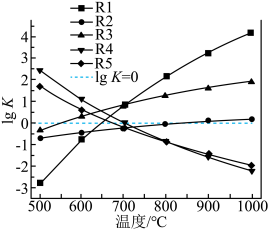
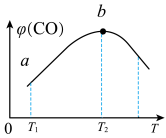
①下图表示R1反应中___________ (填化学式)固体的晶胞结构。 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。___________ (填“升高温度”或“降低温度”),简述判断的理由:___________ 。
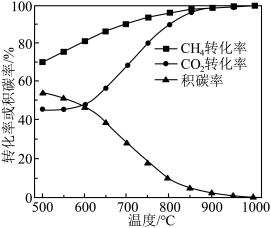
(3)在 、进料配比
、进料配比 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。___________ ℃。
②在最佳温度、p压强下,向某2L的恒容密闭容器中加入2mol 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
___________ (保留两位有效数字,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压=物质的量分数×平衡总压强)。
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol 和1mol CO,发生反应
和1mol CO,发生反应 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。
___________  ;15min时改变的条件不可能是
;15min时改变的条件不可能是___________ (填标号)。
A.充入 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
(1)已知:
(2)甲烷干重整过程中可能存在反应:
R1:
R2:
R3:
R4:
R5:
①下图表示R1反应中
(3)在
②在最佳温度、p压强下,向某2L的恒容密闭容器中加入2mol
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
| A. | B. |
| C. | D.体系的温度不再变化 |
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol
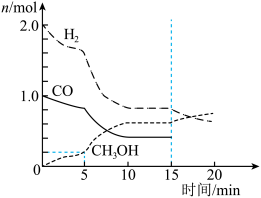
A.充入
2024·甘肃白银·模拟预测
类题推荐  和
和 既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(
既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气( )的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
)的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
(1)已知在 、298K条件下,各物质燃烧热数据如下表:
、298K条件下,各物质燃烧热数据如下表:
则甲烷与二氧化碳重整反应制合成气的热化学方程式为:________________ ;
(2)在T℃时,向容积为2L的刚性容器中充入
 和
和
 。反应体系中
。反应体系中 的物质的量随时间变化关系如下表:
的物质的量随时间变化关系如下表:
①20min时,
________  ;当反应进行到60min时,
;当反应进行到60min时,
________ 20min时 的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:
的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________ 。
A.将反应时间延长至150min B.移除一部分合成气
C.适当提高反应升高温度 D.改用高效催化剂
②反应进行到下列各图的p点时,能够说明该反应达到平衡状态的是:___________ 。
A.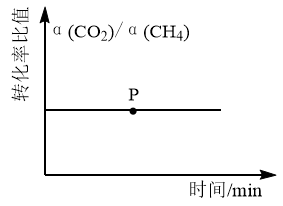 B.
B. C.
C.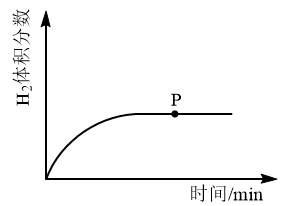 D.
D.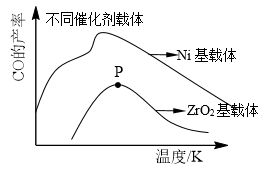
③已知:p(H2)、p(CO)、p(CH4)和p(CO2)为各组分的平衡分压(气体分压p=气体总压p总×体积分数),p总为平衡总压。若开始测得反应体系的压强为3.0Mpa,则合成气反应达到平衡状态时Kp=________ 。(结果保留一位小数)
(3)由于原料气的 比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%
比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10% 催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为
催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________ (横坐标表示Sr助剂的质量含量),判断的理由是________________ (写出两点)

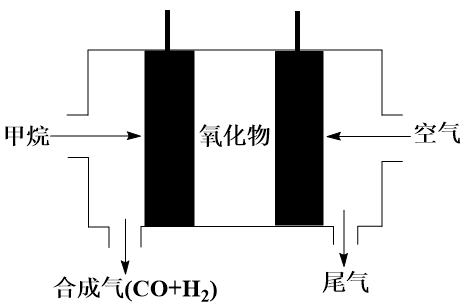
(4)如图所示,以 为燃料气,高温电化学法制备合成气的发电系统中,
为燃料气,高温电化学法制备合成气的发电系统中, 在电场作用下,通过氧化物电解质中氧空位迁移到负极,与
在电场作用下,通过氧化物电解质中氧空位迁移到负极,与 发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:
发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________ 。
对甲烷和 的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合
的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合 重整反应有:
重整反应有:
反应(ⅰ):
 kJ⋅mol
kJ⋅mol
反应(ⅱ):
 kJ⋅mol
kJ⋅mol
(1)写出表示CO燃烧热的热化学方程式:___________ 。
(2)在两个体积均为1 L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ⅱ): (不发生其它反应),
(不发生其它反应), 的平衡转化率如下表所示:
的平衡转化率如下表所示:
①下列能说明反应达到平衡状态是___________ 。
A.
B.容器内各物质的浓度满足
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②上述反应达到平衡后,下列变化一定能使平衡向正向移动的是___________
A.恒容通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
③若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:
___________ (用含t的表达式表示)。
④达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:
___________  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(3)将 和
和 以物质的量比为4∶3充入盛有催化剂的恒容密闭容器内,发生上述反应(ⅰ):
以物质的量比为4∶3充入盛有催化剂的恒容密闭容器内,发生上述反应(ⅰ): ,测得相同时间CO的体积分数[
,测得相同时间CO的体积分数[ ]与温度(T)的关系如图如示。
]与温度(T)的关系如图如示。
① °C时,CO体积分数最大的原因是
°C时,CO体积分数最大的原因是___________ 。
②若 ℃时,容器内起始压强为
℃时,容器内起始压强为 ,平衡时CO的体积分数为20%,则反应的平衡常数
,平衡时CO的体积分数为20%,则反应的平衡常数
___________ (用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
反应(ⅰ):
反应(ⅱ):
(1)写出表示CO燃烧热的热化学方程式:
(2)在两个体积均为1 L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ⅱ):
| 起始物质的量(n)/mol | |||||
| CO | |||||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
A.
B.容器内各物质的浓度满足
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②上述反应达到平衡后,下列变化一定能使平衡向正向移动的是
A.恒容通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
③若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:
④达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:
(3)将

①
②若
对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)⇌2CO(g)+4H2(g)△H=-71.4kJ•mol-1
反应(ii):CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H=+247.0 kJ•mol-1
(1)写出表示CO燃烧热的热化学方程式:_____ 。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)⇌2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如表所示:
①下列条件能说明反应达到平衡状态的是_____ 。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ_____ n(CO)Ⅱ(填“>”、“=”或“<”)
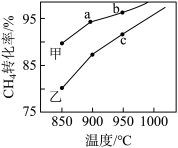
(3)将一定量的甲烷和氧气混合完成反应(i),其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图所示。c点_____ (填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____ 。
(4)CO2也可通过催化加氢合成乙醇,其反应原理为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。通过实验得到下列图象:
图1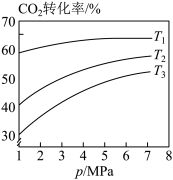 图2
图2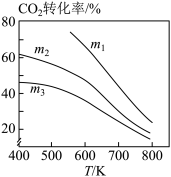 图3
图3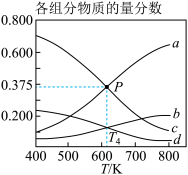
①图1中投料比相同,温度从高到低的顺序为_________ 。
②图2中m1、m2、m3从大到小的顺序为_________ 。
③图3表示在总压为5 MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数KP的计算式为_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
反应(i):2CH4(g)+O2(g)⇌2CO(g)+4H2(g)△H=-71.4kJ•mol-1
反应(ii):CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H=+247.0 kJ•mol-1
(1)写出表示CO燃烧热的热化学方程式:
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)⇌2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如表所示:
| 容器 | 起始物质的量(n) / mol | CO2的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ
(3)将一定量的甲烷和氧气混合完成反应(i),其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图所示。c点

(4)CO2也可通过催化加氢合成乙醇,其反应原理为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)∆H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。通过实验得到下列图象:
图1
 图2
图2 图3
图3
①图1中投料比相同,温度从高到低的顺序为
②图2中m1、m2、m3从大到小的顺序为
③图3表示在总压为5 MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数KP的计算式为
(1)已知在
| 物质(g) | ||||
| 燃烧热( | -890.0 | -283.0 | -285.0 | 0 |
则甲烷与二氧化碳重整反应制合成气的热化学方程式为:
(2)在T℃时,向容积为2L的刚性容器中充入
| 时间/min | 0 | 20 | 50 | 60 | 100 |
| 0.5 | 0.48 | 0.25 | 0.25 | 0.25 |
①20min时,
A.将反应时间延长至150min B.移除一部分合成气
C.适当提高反应升高温度 D.改用高效催化剂
②反应进行到下列各图的p点时,能够说明该反应达到平衡状态的是:
A.
 B.
B. C.
C. D.
D.
③已知:p(H2)、p(CO)、p(CH4)和p(CO2)为各组分的平衡分压(气体分压p=气体总压p总×体积分数),p总为平衡总压。若开始测得反应体系的压强为3.0Mpa,则合成气反应达到平衡状态时Kp=
(3)由于原料气的

(4)如图所示,以

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


