解答题-实验探究题 较难0.4 引用1 组卷183
水杨酸异戊酯( ,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
②按照下图搭建反应装置,在145~155℃油浴下加热回流至不再有水生成。
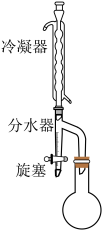
④干燥、减压蒸馏有机层,收集到31.2g产物。
⑤用红外光谱仪和核磁共振仪对产物进行表征。
已知:
①环己烯(沸点83℃)可与水形成沸点为70℃的共沸物。
②沸点:水杨酸211℃、异戊醇131℃、环己烯83℃、水杨酸异戊酯282℃。
回答以下问题:
(1)反应中浓硫酸的作用是吸水剂和
(2)写出制备水杨酸异戊酯的化学方程式
(3)步骤②中表明反应中不再有水生成的现象是
(4)洗涤反应液时需要使用的主要仪器是
(5)步骤③中NaHCO3溶液的作用是
(6)本次实验的产率为
(7)红外光谱图中可获得产物信息包括
a.产物中碳氧双键键长 b.产物相对分子质量
c.产物中含有酯基结构 d.产物中氧元素质量分数
23-24高三下·广西南宁·阶段练习
类题推荐
甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)已知:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H=+206.0kJ/mol-1
CH4(g)+H2O(g)⇌CH3OH(g)+H2(g) ∆H=+77.0kJ/mol-1
则CO和H2反应生成CH3OH(g)的热化学方程式是______________________ 。
(2)甲醇可用于合成3,5-二甲氧基苯酚,反应如下:
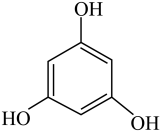 +2CH3OH
+2CH3OH
 +2H2O
+2H2O
反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
①分离出甲醇的操作是______________________ (填字母序号)。
a.蒸馏 b.分液 c.结晶
②洗涤时,可用于除去有机层中的氯化氢的试剂是______________________ (填字母序号)。
a.Na2CO3溶液 b.NaHCO3溶液 c.NaOH溶液
(3)甲醇可用于实验室制备丙炔酸甲酯(CH C—COOCH3,沸点为103~105℃)。
C—COOCH3,沸点为103~105℃)。
反应为:CH≡C—COOH+CH3OH CH≡C—COOCH3+H2O
CH≡C—COOCH3+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14g丙炔酸、50mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置如图所示)。

步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
①仪器A的名称是______________ ,蒸馏烧瓶中加入碎瓷片的目的是_______________ 。
②步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是______________________ ;分离出有机相的操作名称为______________________ 。
③步骤4中,蒸馏时不能用水浴加热的原因是______________________ 。
(1)已知:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H=+206.0kJ/mol-1
CH4(g)+H2O(g)⇌CH3OH(g)+H2(g) ∆H=+77.0kJ/mol-1
则CO和H2反应生成CH3OH(g)的热化学方程式是
(2)甲醇可用于合成3,5-二甲氧基苯酚,反应如下:
 +2CH3OH
+2CH3OH +2H2O
+2H2O反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | -97.8 | 易溶于水 |
| 3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是
a.蒸馏 b.分液 c.结晶
②洗涤时,可用于除去有机层中的氯化氢的试剂是
a.Na2CO3溶液 b.NaHCO3溶液 c.NaOH溶液
(3)甲醇可用于实验室制备丙炔酸甲酯(CH
反应为:CH≡C—COOH+CH3OH
实验步骤如下:
步骤1:在反应瓶中,加入14g丙炔酸、50mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置如图所示)。

步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
①仪器A的名称是
②步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是
③步骤4中,蒸馏时不能用水浴加热的原因是
乙酸正丁酯是一种优良的有机溶剂。通常由乙酸与正丁醇在硫酸催化下发生酯化反应来制备。
实验原理:
反应装置如图甲所示(夹持装置略)。
实验步骤:
①在100mL圆底烧瓶中加入9.25mL正丁醇和6mL乙酸,混匀,再加入3~4滴浓硫酸,摇匀;加入沸石,按如图装置安装仪器,加热反应一段时间;
②反应完成,停止加热;反应液冷却后,将分水器中分出的酯层和烧瓶中的反应液一起倒入分液漏斗中;
③依次用水、碳酸钠溶液、水洗涤至中性,然后将酯层倒入锥形瓶中,加少量无水硫酸镁;
④将锥形瓶中的所有物质全部转移到蒸馏烧瓶中,安装好蒸馏装置(如图乙所示,气密性良好,部分夹持装置略),加热蒸馏,收集馏分。
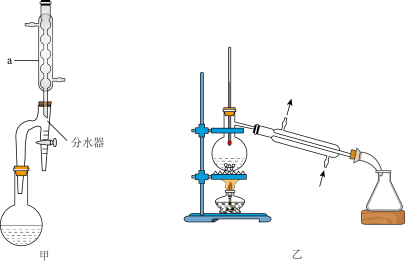
已知:①
②乙酸正丁酯、正丁醇和水三者可形成二元或三元恒沸混合物,当冷凝为液体时,在分水器中分为两层,下层为溶解少量酯和醇的水,可逐次分出。
回答下列问题:
(1)仪器a的名称为___________ 。实验中加入沸石的作用为___________ 。
(2)步骤②中判断反应基本完成的实验现象为___________ :与常规发生装置相比,加装分水器的优点是___________ 。
(3)步骤③中用Na2CO3溶液洗涤的主要目的是___________ 。
(4)本实验中正丁醇可能发生副反应生成其它有机物,反应的方程式为___________ 、___________ 。
(5)写出步骤④中(包括乙装置)存在的错误:___________ 。
(6)本实验中,按照正确的实验操作共收集到馏分7.3g,则产率为___________ %(保留两位有效数字)。
实验原理:
反应装置如图甲所示(夹持装置略)。
实验步骤:
①在100mL圆底烧瓶中加入9.25mL正丁醇和6mL乙酸,混匀,再加入3~4滴浓硫酸,摇匀;加入沸石,按如图装置安装仪器,加热反应一段时间;
②反应完成,停止加热;反应液冷却后,将分水器中分出的酯层和烧瓶中的反应液一起倒入分液漏斗中;
③依次用水、碳酸钠溶液、水洗涤至中性,然后将酯层倒入锥形瓶中,加少量无水硫酸镁;
④将锥形瓶中的所有物质全部转移到蒸馏烧瓶中,安装好蒸馏装置(如图乙所示,气密性良好,部分夹持装置略),加热蒸馏,收集馏分。

已知:①
| 乙酸 | 无色液体,密度1.05g·cm-3,沸点117.9℃,Mr=60 |
| 正丁醇 | 无色液体,微溶于水,沸点118℃,密度0.8g·cm-3,Mr=74 |
| 乙酸正丁酯 | 无色油状液体,不溶于水,沸点126.3℃,Mr=116 |
回答下列问题:
(1)仪器a的名称为
(2)步骤②中判断反应基本完成的实验现象为
(3)步骤③中用Na2CO3溶液洗涤的主要目的是
(4)本实验中正丁醇可能发生副反应生成其它有机物,反应的方程式为
(5)写出步骤④中(包括乙装置)存在的错误:
(6)本实验中,按照正确的实验操作共收集到馏分7.3g,则产率为
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。实验室制备硝基苯的装置和有关数据如下:
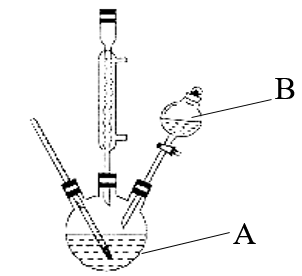
实验步骤:
①在A中加入用20mL浓硫酸与18mL浓硝酸配制的混酸。
②向室温下的混酸中逐滴加入20mL苯,混合均匀。
③加热A至50~60℃,充分反应。
④反应液冷却至室温,依次用水、10%NaOH溶液、水洗涤,分离得到粗产品。
⑤将用无水CaCl2固体干燥后的粗产品进行蒸馏,得到纯硝基苯18.45g。
回答下列问题:
(1)配制混酸的操作是将_________ 加入_________ 中。
(2)仪器B的名称是____________ 。
(3)写出制备硝基苯的化学方程式____________ 。
(4)步骤③的加热方式是_________ 。
(5)步骤④第二次水洗时,粗产品在_________ (填“上”或“下”)层,分离出粗产品的操作方法为 __________ 。
(6)硝基苯的产率是________________ (提示: )
)

| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/(g·cm-3) | 溶解性 |
| 苯 | 5.5 | 80 | 0.9 | 微溶于水 |
| 硝基苯 | 5.7 | 201.9 | 1.2 | 难溶于水 |
| 浓硝酸 | / | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | / | 338 | 1.8 | 易溶于水 |
实验步骤:
①在A中加入用20mL浓硫酸与18mL浓硝酸配制的混酸。
②向室温下的混酸中逐滴加入20mL苯,混合均匀。
③加热A至50~60℃,充分反应。
④反应液冷却至室温,依次用水、10%NaOH溶液、水洗涤,分离得到粗产品。
⑤将用无水CaCl2固体干燥后的粗产品进行蒸馏,得到纯硝基苯18.45g。
回答下列问题:
(1)配制混酸的操作是将
(2)仪器B的名称是
(3)写出制备硝基苯的化学方程式
(4)步骤③的加热方式是
(5)步骤④第二次水洗时,粗产品在
(6)硝基苯的产率是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


