解答题-原理综合题 适中0.65 引用1 组卷43
方法1:化学还原
(1)以
①
②
写出
(2)利用二氧化碳合成淀粉,首先是利用二氧化碳制备甲醇。已知
Ⅰ.
Ⅱ.
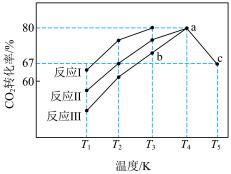
在压强为P,
①有利于提高
A.适当降温 B.适当升温 C.选择合适的催化剂
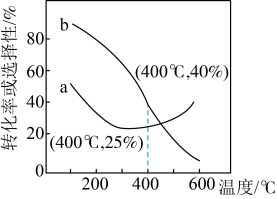
②温度高于350℃时,体系中发生的反应以
③其中表示平衡时
(3)
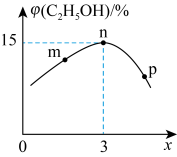
方法2:用电解法可将
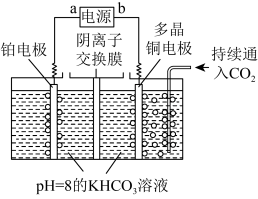
(4)用如图装置电解二氧化碳制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中
2024·青海西宁·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网