解答题-原理综合题 较易0.85 引用1 组卷84
氮是自然界各种生物体生命活动不可缺少的重要元素。
(1)下列说法中,不正确的是___________ (填字母序号)。
a.氮原子的最外层有5个电子,氮气分子中存在氮氮三键,常温下化学性质稳定
b.氮元素位于元素周期表的第二周期,第VA族
c.氮元素的最低化合价为-3价,最高化合价为+5价
d.根据元素周期律推测,氮化硅的化学式为SiN
(2) 分子不能被大多数动植物直接吸收。植物吸收和利用效果最好的是
分子不能被大多数动植物直接吸收。植物吸收和利用效果最好的是 (铵根离子),将
(铵根离子),将 转化为
转化为  需与
需与___________ (填“酸”或“碱”)反应。写出该反应离子方程式:___________ 和 的电子式
的电子式___________ 。
(3)大自然通过闪电可将空气中的氮气转化为含氮化合物,从而实现自然固氮。该过程中生成的含氮化合物是___________ 。
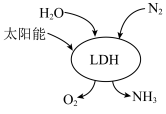
(4)我国科研团队借助一种固体催化剂(LDH),在常温常压和可见光作用下实现了人工固氮。其过程如图所示。写出该过程中反应的化学方程式:___________ 。___________ 。
(6)上述流程中,需要使用催化剂的反应是___________ (填“Ⅰ”、“Ⅱ”或“Ⅲ”),使用催化剂的目的是___________ 。
(7)工业合成氨反应为: 对其描述正确的是___________(填序号)。
对其描述正确的是___________(填序号)。
(8)采用上述工业制硝酸的流程,若 (已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为
(已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为___________ g。
(1)下列说法中,不正确的是
a.氮原子的最外层有5个电子,氮气分子中存在氮氮三键,常温下化学性质稳定
b.氮元素位于元素周期表的第二周期,第VA族
c.氮元素的最低化合价为-3价,最高化合价为+5价
d.根据元素周期律推测,氮化硅的化学式为SiN
(2)
(3)大自然通过闪电可将空气中的氮气转化为含氮化合物,从而实现自然固氮。该过程中生成的含氮化合物是
(4)我国科研团队借助一种固体催化剂(LDH),在常温常压和可见光作用下实现了人工固氮。其过程如图所示。写出该过程中反应的化学方程式:
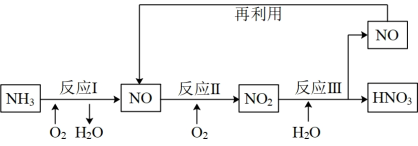
(6)上述流程中,需要使用催化剂的反应是
(7)工业合成氨反应为:
| A.在上述条件下, |
| B.若其他条件一定时,增大氮气的浓度,可增大反应速率 |
| C.达到平衡时,体系中各物质的浓度一定相等 |
| D.当正反应速率等于逆反应速率且不为零时,该反应达到平衡状态 |
(8)采用上述工业制硝酸的流程,若
23-24高一下·天津·期中
类题推荐
硝酸是重要的化工原料,工业上以氨为原料制硝酸,反应流程如下图所示:
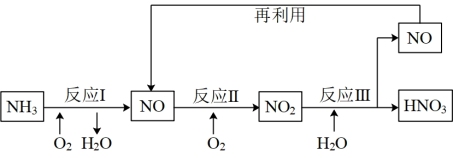
(1)写出反应II的化学方程式:___________ 。
(2)上述流程中,需要使用催化剂的反应是___________ (填“I”、“II”或“III”),使用催化剂的目的是______ 。
(3)盛装制得的浓硝酸,可选择___________ (填序号)作为罐体材料。
A.铜 B.镁 C.铝
(4)工业合成氨的反应为: N2(g) + 3H2(g) 2NH3(g),对该反应的描述正确的是___________(填序号)。
2NH3(g),对该反应的描述正确的是___________(填序号)。
(5)实验室中可用如图装置(夹持装置已略去)制取氨气,其反应原理是______ (用化学方程式表示)。

(6)该流程中NO气体循环再利用的意义是___________ 。
(7)采用上述工业制硝酸的流程,若224 L NH3 (已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为___________ g。

(1)写出反应II的化学方程式:
(2)上述流程中,需要使用催化剂的反应是
(3)盛装制得的浓硝酸,可选择
A.铜 B.镁 C.铝
(4)工业合成氨的反应为: N2(g) + 3H2(g)
| A.在上述条件下, N2能全部转化为NH3 |
| B.若其他条件一定时,增大氮气的浓度,可增大反应速率 |
| C.达到平衡时,体系中各物质的浓度一定相等 |
| D.当正反应速率等于逆反应速率且不为零时,该反应达到平衡状态 |

(6)该流程中NO气体循环再利用的意义是
(7)采用上述工业制硝酸的流程,若224 L NH3 (已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为
利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺。在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g) 2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:
(1)下列各项能说明该反应已达到平衡状态的是____________ (填写序号字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)容器乙中反应从开始到达平衡的反应速率为v(H2)=_________
(3)在该温度下甲容器中反应的平衡常数K________ (用含c1的代数式表示).
(4)分析上表数据,下列关系正确的是_________ (填序号):
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1 d.K甲=K乙=K丙
(5)氨和尿素溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2.写出尿素与NO、NO2三者等物质的量反应的化学方程式__________________ .
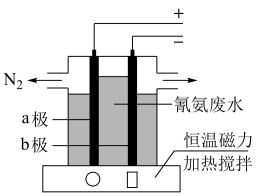
(6)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化.如图通过直接电化学法能有效除去废水中的氨.其中阴离子的流动方向为__________ (填“a极”或“b极”),电解过程中,b极区的pH_____________ (填“增大”或“减小”或“不变”),阳极反应方程式为__________ .
 2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
| 平衡常数/L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)容器乙中反应从开始到达平衡的反应速率为v(H2)=
(3)在该温度下甲容器中反应的平衡常数K
(4)分析上表数据,下列关系正确的是
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1 d.K甲=K乙=K丙
(5)氨和尿素溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2.写出尿素与NO、NO2三者等物质的量反应的化学方程式
(6)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化.如图通过直接电化学法能有效除去废水中的氨.其中阴离子的流动方向为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



