解答题-工业流程题 适中0.65 引用1 组卷28
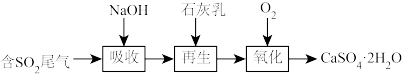
蒽醌二磺酸钠法(ADA法)对合成氨原料气进行脱硫(H2S)的工艺流程如图所示,该工艺的优势之一在于只要向“再生吸收液”不断通如空气即可实现连续吸收H2S气体。
ii.酒石酸钾钠、EDTA可分别与V4+、Fe3+形成可溶性配合物。
(1)“吸收”时,发生反应的离子方程式为___________ 。
(2)“脱硫”时,NaVO3先转化为Na2V4O9同时可得到S,则该转化过程反应的化学方程式为___________ 。
(3)“还原”时,氧化态ADA(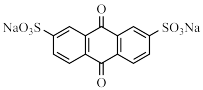 )转化为还原态ADA(
)转化为还原态ADA(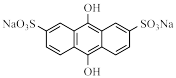 ),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为
),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为___________ ,Na2V4O9参与反应过程中氧化剂和还原剂的物质的量之比为___________ 。
(4)“氧化”时,ADA(还原态) ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是
ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是___________ ;加入EDTA的目的是___________ 。
(5)“再生吸收液”中可循环使用的物质有___________ (填选项字母)。
A.NaOH B.酒石酸钾钠 C.NaVO3 D.EDTA E.ADA
ii.酒石酸钾钠、EDTA可分别与V4+、Fe3+形成可溶性配合物。
(1)“吸收”时,发生反应的离子方程式为
(2)“脱硫”时,NaVO3先转化为Na2V4O9同时可得到S,则该转化过程反应的化学方程式为
(3)“还原”时,氧化态ADA(
 )转化为还原态ADA(
)转化为还原态ADA( ),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为
),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为(4)“氧化”时,ADA(还原态)
(5)“再生吸收液”中可循环使用的物质有
A.NaOH B.酒石酸钾钠 C.NaVO3 D.EDTA E.ADA
23-24高三下·河北沧州·阶段练习
类题推荐
I 碱法脱硫。用K2CO3溶液吸收H2S。
已知:常温下,氢硫酸和碳酸的电离常数如表。
【小题1】K2CO3溶液中微粒浓度关系正确的是___________。
【小题2】常温下,比较等物质的量浓度的NaHS与NaHCO3溶液的pH___________ 。
A.前者大 B.后者大 C.无法比较
向某FeCl2溶液中加入一定浓度的NaHS溶液,采用分光光度法测得
[Fe2+]=8.88×10-5mol•L-1.(常温下,Ksp(FeS)=6.3×10-18)
【小题3】计算溶液中的 =
=___________ 。
II. 热分解法脱硫。在2 L恒容密闭容器中发生反应2H2S(g) S2(g) + 2H2(g)。
S2(g) + 2H2(g)。
【小题4】985℃时,若加入1mol H2S,经过5s达到平衡,此时H2S的转化率为40%。
则v(S2) =___________ ,该温度下K=___________ (计算结果保留两位有效数字)。
III. Fe2(SO4)3脱硫。
吸收液[Fe2(SO4)3]作用原理如下:
① H2S(g)⇌H2S(aq) ②H2S(aq) ⇌H++HS- ③HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度以及溶液起始pH的关系如图所示。___________ 。原因是___________ 。
【小题6】吸收液过滤出S后,可通入空气再生,写出该反应的离子方程式并标出电子转移方向和数目。___________ 。
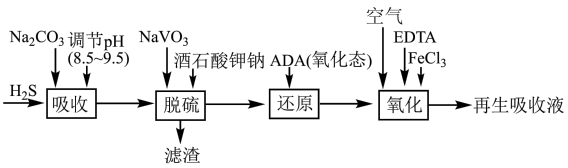
IV. 电化学法脱硫(如图)___________ 经负载流向电极___________ 。(均选填“A”或“B”) A极发生的电极反应式为___________ 。
已知:常温下,氢硫酸和碳酸的电离常数如表。
| 二元酸 | Ka1 | Ka2 |
| H2S | 1.1×10-7 | 7.1×10-15 |
| H2CO3 | 4.5×10-7 | 4.7×10-11 |
【小题1】K2CO3溶液中微粒浓度关系正确的是___________。
| A.[K+]= [ | B.[K+]= [ |
| C.[K+]= 2[ | D.[K+]= [ |
A.前者大 B.后者大 C.无法比较
向某FeCl2溶液中加入一定浓度的NaHS溶液,采用分光光度法测得
[Fe2+]=8.88×10-5mol•L-1.(常温下,Ksp(FeS)=6.3×10-18)
【小题3】计算溶液中的
II. 热分解法脱硫。在2 L恒容密闭容器中发生反应2H2S(g)
【小题4】985℃时,若加入1mol H2S,经过5s达到平衡,此时H2S的转化率为40%。
则v(S2) =
III. Fe2(SO4)3脱硫。
吸收液[Fe2(SO4)3]作用原理如下:
① H2S(g)⇌H2S(aq) ②H2S(aq) ⇌H++HS- ③HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度以及溶液起始pH的关系如图所示。

【小题6】吸收液过滤出S后,可通入空气再生,写出该反应的离子方程式并标出电子转移方向和数目。
IV. 电化学法脱硫(如图)
已知CH3COOH是常见的弱酸,现有常温下0.lmol·L-1的CH3COOH溶液。
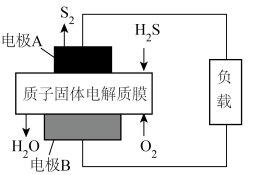
(1)取0.10molCH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示。
①n(H+):a_____ b(填“>”、“<”或“=”,下同)。
②c(CH3COO-):a_____ b。
③完全中和时消耗NaOH的物质的量:a_____ b。
(2)若向醋酸中加入氢氧化钠溶液,使醋酸恰好被中和,所得溶液的pH_____ 7(填“大于”“小于”或“等于”),用离子方程式表示其原因_____ ;中和后所得溶液中离子浓度由大到小的顺序为_____ 。
(3)25℃时,部分物质的电离平衡常数如表所示:
①CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为_____ 。
②焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。根据上述数据,从理论上推测同为0.1mol·L-1的K2CO3溶液和HCN混合后,最可能发生反应的离子方程式为_____ 。
(1)取0.10molCH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示。

①n(H+):a
②c(CH3COO-):a
③完全中和时消耗NaOH的物质的量:a
(2)若向醋酸中加入氢氧化钠溶液,使醋酸恰好被中和,所得溶液的pH
(3)25℃时,部分物质的电离平衡常数如表所示:
| CH3COOH | H2CO3 | HCN |
| 1.7×10-5 | Ka1=4.3×10-7、Ka2=5.6×10-11 | 4.9×10-10 |
①CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为
②焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。根据上述数据,从理论上推测同为0.1mol·L-1的K2CO3溶液和HCN混合后,最可能发生反应的离子方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网