解答题-实验探究题 较难0.4 引用1 组卷168
某小组通过测定吸光度的方法确定配位化合物的配体数x。
已知:
a. 能与邻菲罗啉(phen)形成稳定的橙红色配离子:
能与邻菲罗啉(phen)形成稳定的橙红色配离子: ,生成的配离子能吸收波长为510nm的光。
,生成的配离子能吸收波长为510nm的光。
b.根据朗伯-比尔定律,其它条件相同时,溶液吸光度A与其物质的量浓度c成正比: ,可在吸光度最高点得到配合物配比。
,可在吸光度最高点得到配合物配比。
Ⅰ.配制溶液
(1)用 (
( )晶体配制500mL含
)晶体配制500mL含 的溶液,需要用到下列仪器中的
的溶液,需要用到下列仪器中的________ 。(填字母)________ g(分析天平精确度为0.0001g)。另准确配制 的邻菲罗啉溶液备用。
的邻菲罗啉溶液备用。
Ⅱ.测定吸光度
取若干试管编号,按照下表用量混合反应溶液,并依次测定波长为510nm时溶液的吸光度:
(2)表格中a的数值为________ ,混合时需要加入缓冲溶液使溶液的pH保持在酸性环境,其原因是________ 。
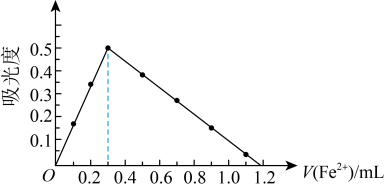
(3)所测定的结果如下图所示,可求得配体数
________ 。
该小组同学发现实验过程中实测的吸光度与文献数值有一定偏差,继续探究原因。
查阅资料 也能与phen配位,形成淡蓝色配合物
也能与phen配位,形成淡蓝色配合物
提出猜想 在配制 溶液时,可能有部分溶质被空气氧化
溶液时,可能有部分溶质被空气氧化
(4)小组同学设计实验验证了猜想的正确性,其操作和现象是________ 。
(5)甲同学提出,为排除上述干扰,可在配制 溶液时,加入少量Fe粉,但乙同学认为不可以,其原因是
溶液时,加入少量Fe粉,但乙同学认为不可以,其原因是________ 。
经查阅资料,小组同学最终选用了盐酸羟胺( )代替铁粉完成了实验,此反应的离子方程式为
)代替铁粉完成了实验,此反应的离子方程式为_________ : ________
________ ________
________ 。
。
(6)铁盐与亚铁盐在生活中使用广泛,请任写出一种用途________ 。
已知:
a.
b.根据朗伯-比尔定律,其它条件相同时,溶液吸光度A与其物质的量浓度c成正比:
Ⅰ.配制溶液
(1)用

Ⅱ.测定吸光度
取若干试管编号,按照下表用量混合反应溶液,并依次测定波长为510nm时溶液的吸光度:
| 编号 | V(phen)/mL | V(缓冲溶液)/mL | V(蒸馏水)/mL | |
| 1 | 0.00 | 1.20 | 1.20 | 0.60 |
| 2 | 0.06 | 1.14 | 1.20 | 0.60 |
| 3 | a | 1.08 | 1.20 | 0.60 |
| …… | ||||
| n | 1.20 | 0.00 | 1.20 | 0.60 |
(2)表格中a的数值为
(3)所测定的结果如下图所示,可求得配体数
该小组同学发现实验过程中实测的吸光度与文献数值有一定偏差,继续探究原因。
查阅资料
提出猜想 在配制
(4)小组同学设计实验验证了猜想的正确性,其操作和现象是
(5)甲同学提出,为排除上述干扰,可在配制
经查阅资料,小组同学最终选用了盐酸羟胺(
(6)铁盐与亚铁盐在生活中使用广泛,请任写出一种用途
2024·广东佛山·模拟预测
类题推荐
二氧化硫是重要的化工原料。某实验小组欲制备SO2并探究其相关反应。
Ⅰ.SO2的制备
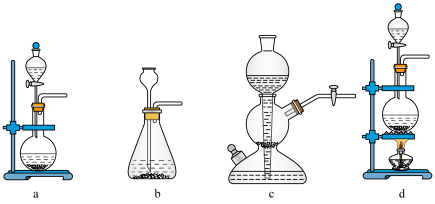
(1)实验小组以亚硫酸钠(Na2SO3)粉末和70%的硫酸为原料制取SO2,并要求能够控制反应速率,下列可选用的仪器是___________ (填标号)。
实验事实:小组同学向1mL0.5mol/LFeCl3溶液中通入SO2至饱和,溶液先变成红色,静置5min后溶液红色变浅,慢慢变为黄色,静置9h后溶液变为绿色。
提出问题:溶液变为红色与什么微粒有关?
查阅资料:①Fe3+易与阴离子形成配合物,且Fe(Ⅲ)配合物常呈现特殊颜色。
②SO2溶液中,存在的含有硫元素的微粒有SO2、H2SO3、 和
和 。
。
提出猜想:a.溶液变为红色与 有关;
有关;
b.溶液变为红色与 有关。
有关。
实验验证:为验证猜想,小组同学做了如下实验。
(2)完成表格:实验②中加入___________ 溶液。
上述两个实验中溶液都变为红色,因此无法得出实验结论。
进一步验证:为进一步验证猜想,小组同学配制系列溶液并测量其吸光度,绘制出右图曲线。
参比溶液:0.5mL1mol/LFeCl3溶液+0.5mL1mol/LNa2SO3溶液+7mL蒸馏水
图中A、B、C三点对应加入各试剂的体积如表所示。
说明:①已知吸光度大小与溶液中红色物质浓度成正比。②参比溶液的作用是空白对照,设定参比溶液的吸光度为0。
(3)补充上表中数值,其中a=___________ ,b=___________ 。
实验结论
(4)根据以上实验,可以推测:溶液变为红色与___________ (填离子符号)有关。
拓展探究
将静置9h后变为绿色的溶液分为两份,向其中一份溶液中滴加铁氰化钾溶液,有蓝色沉淀生成;向另一份溶液中滴加盐酸酸化的氯化钡溶液,有白色沉淀生成。
(5)①写出溶液变为绿色所发生氧化还原反应的离子方程式:___________ 。
②试从平衡移动的角度,分析溶液红色变浅直至消失的原因:___________ 。
(6)写出二氧化硫在生产生活中的一种应用:___________ 。
Ⅰ.SO2的制备
(1)实验小组以亚硫酸钠(Na2SO3)粉末和70%的硫酸为原料制取SO2,并要求能够控制反应速率,下列可选用的仪器是
实验事实:小组同学向1mL0.5mol/LFeCl3溶液中通入SO2至饱和,溶液先变成红色,静置5min后溶液红色变浅,慢慢变为黄色,静置9h后溶液变为绿色。
提出问题:溶液变为红色与什么微粒有关?
查阅资料:①Fe3+易与阴离子形成配合物,且Fe(Ⅲ)配合物常呈现特殊颜色。
②SO2溶液中,存在的含有硫元素的微粒有SO2、H2SO3、
提出猜想:a.溶液变为红色与
b.溶液变为红色与
实验验证:为验证猜想,小组同学做了如下实验。
| 实验 | 实验操作 | 实验现象 |
| ① | 取1mL1mol/LFeCl3溶液于试管中,加入3mL1mol/LNa2SO3溶液,观察5min内的颜色变化 | 溶液变为红色 |
| ② | 取1mL1mol/LFeCl3溶液于试管中,加入___________溶液,观察5min内的颜色变化 | 溶液变为红色 |
(2)完成表格:实验②中加入
上述两个实验中溶液都变为红色,因此无法得出实验结论。
进一步验证:为进一步验证猜想,小组同学配制系列溶液并测量其吸光度,绘制出右图曲线。
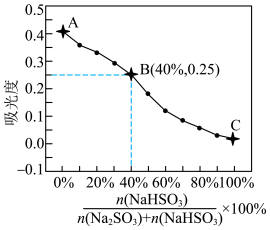
参比溶液:0.5mL1mol/LFeCl3溶液+0.5mL1mol/LNa2SO3溶液+7mL蒸馏水
图中A、B、C三点对应加入各试剂的体积如表所示。
| 点 | 1mol/LFeCl3/mL | 1mol/LNa2SO3/mL | 1mol/LNaHSO3/mL |
| A | 0.5 | 4.0 | 0.0 |
| B | a | b | |
| C | 0.0 | 4.0 |
(3)补充上表中数值,其中a=
实验结论
(4)根据以上实验,可以推测:溶液变为红色与
拓展探究
将静置9h后变为绿色的溶液分为两份,向其中一份溶液中滴加铁氰化钾溶液,有蓝色沉淀生成;向另一份溶液中滴加盐酸酸化的氯化钡溶液,有白色沉淀生成。
(5)①写出溶液变为绿色所发生氧化还原反应的离子方程式:
②试从平衡移动的角度,分析溶液红色变浅直至消失的原因:
(6)写出二氧化硫在生产生活中的一种应用:
某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为_____ (填序号)。
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)影响物质氧化性强弱的因素有_____ 、_____ 。
(3)已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是_____ 。
a.Fe3+、Br- b.Fe3+、S2- c.NO 、H+、I- d.H+、MnO
、H+、I- d.H+、MnO 、I-
、I-
(4)向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为_____ 。(已知MnO 在酸性环境下的产物为Mn2+)
在酸性环境下的产物为Mn2+)
(5)往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
猜想1:______。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
①猜想1为______ ,实验1所用试剂a为______ ,实验1的现象为______ 。
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为______ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 | H2O2 | H2O2(酸化) | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | NaBr | KI | Na2S |
| 浓度 | 5% | 5% | 0.1mol•L-1 | |||||
| 电位值/mV | 276 | 683 | 671 | 1130 | 603 | 362 | 116 | -361 |
(1)浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)影响物质氧化性强弱的因素有
(3)已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是
a.Fe3+、Br- b.Fe3+、S2- c.NO
(4)向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为
(5)往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
猜想1:______。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
| 序号 | 实验操作 | 试剂 | 现象 | 结论 |
| 1 | 分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象 | a | ______ | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确(I2被氧化为IO | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为
某校化学学习小组探究 与
与 溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有
溶液的反应,装置如下图所示,分液漏斗中盛有浓硫酸,锥形瓶中装有 固体。回答下列问题:
固体。回答下列问题:
(1)写出实验中制备 的化学方程式
的化学方程式________ 。
(2)配制100mL
 溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和________ 。
【实验探究】
向3mL
 溶液中通入
溶液中通入 ,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
,观察到溶液立即由黄色变成红棕色,放置12小时后,,红棕色消失,溶液变为浅绿色。结合已有知识,针对溶液呈红棕色学习小组提出以下猜想:
猜想1: 水解产生了红棕色的
水解产生了红棕色的 胶体;
胶体;
猜想2: 与溶液中某种
与溶液中某种 价含硫微粒形成了红棕色的配合物。
价含硫微粒形成了红棕色的配合物。
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,________ ,证明猜想1不成立。
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是 、
、 、
、 中的哪一种(实验均在常温下进行)。
中的哪一种(实验均在常温下进行)。
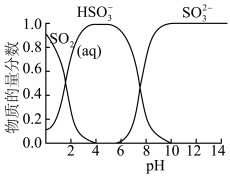
已知:常温下,溶液中 价含硫微粒物质的量分数随pH变化曲线如图所示。
价含硫微粒物质的量分数随pH变化曲线如图所示。________ (填写微粒符号),依据的实验证据是________ 。
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度 ,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
,其中k为摩尔吸收系数;L为液层厚度即光路长度,在实验中液层厚度保持一致;c为有色物质的浓度。
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验结果讨论:若 ,则该因素不影响溶液红棕色的深浅;若
,则该因素不影响溶液红棕色的深浅;若 ,则该因素会影响溶液红棕色的深浅。
,则该因素会影响溶液红棕色的深浅。
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如: 。
。
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为: 溶液,
溶液, 溶液,
溶液, 固体,
固体, 固体
固体
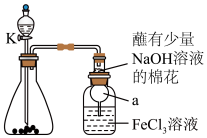
(1)写出实验中制备
(2)配制100mL
【实验探究】
向3mL
猜想1:
猜想2:
(3)为验证上述猜想,甲同学用激光笔照射该红棕色溶液,
(4)乙同学查阅文献得知猜想2正确,并设计了下表3组实验,以确定红棕色配合物的配体是
组别 | 溶液1(1mL) | 溶液2(2mL) | 现象 |
a |
|
| 溶液1和溶液2混合后,组别a、b、c所得溶液红棕色依次加深。 |
b | |||
c |
(5)丙同学查阅资料得知:
利用分光光度计可测定溶液中有色物质的吸光度,吸光度
丙同学经过思考,认为乙同学的实验方案不严谨,除了pH会影响溶液红棕色的深浅,还有一个因素也可能会影响溶液红棕色的深浅。于是设计如下实验进行探究,请帮助该同学完成实验方案,填写下表中空白处。
实验序号 | 操作 | 吸光度 |
1 | 把1mL 0.1mol/L | |
2 |
(6)丁同学查阅资料得知:
配合物在溶液中存在解离平衡,如:
丁同学设计实验,利用分光光度计测定上述溶液中红棕色物质的吸光度,证明解离平衡的存在。请完成表中内容。
实验限选试剂为:
实验序号 | 操作 | 吸光度 | 结论 |
3 | 向3mL 0.1mol/L | ||
4 | 平衡向 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


