解答题-原理综合题 较难0.4 引用1 组卷116
研究 、
、 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
(1)采用 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: 。以下说法正确的是______。
。以下说法正确的是______。
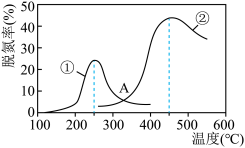
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:__________ 。(填“极性键”、“非极性键”或“极性键和非极性键”)。过程Ⅱ为__________ 过程(填“吸热”或“放热”)。
②已知过程Ⅰ的焓变为 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:__________ 。
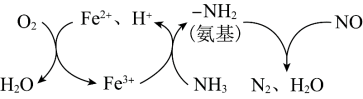
(3) 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
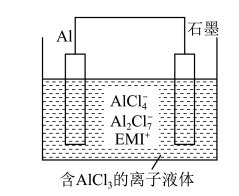
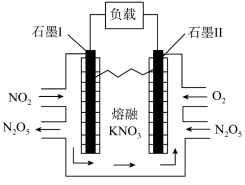
和NO物质的量之比为:__________ 。其中__________ 是催化剂(填化学符号)。______ (填选项)。(A.化学能转化为电能 B.电能转化为化学能),石墨Ⅰ是该电化学装置的______ (填选项)(A.正极 B.负极)石墨Ⅰ电极上发生的电极反应为__________ (提醒:介质为熔融 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为__________ 。
(1)采用
| A.使用催化剂更有利于提高 |
| B.及时吹脱水蒸气,可以提高脱氮率 |
| C.其他条件不变的条件下,改变压强对脱氮率没有影响 |
| D.烟气通过催化剂的流速越快,脱氮效果会越好 |
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:

②已知过程Ⅰ的焓变为
(3)
23-24高二下·江苏盐城·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH (l) + H2O (l)
CH3OH (l) + H2O (l)
 2N2(g) + 3H2O(g)。以下说法正确的是
2N2(g) + 3H2O(g)。以下说法正确的是
 CH3OH (l) + H2O (l)
CH3OH (l) + H2O (l)
 2N2(g) + 3H2O(g)。 以下说法不正确的是
2N2(g) + 3H2O(g)。 以下说法不正确的是