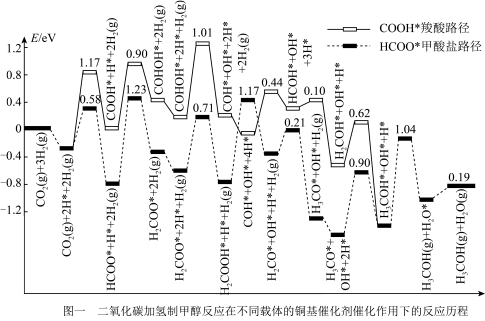解答题-原理综合题 较难0.4 引用2 组卷119
绿色甲醇降碳效应显著,是实现“碳中和”目标的重要举措之一,2024年伊始,绿色甲醇项目被新纳入《产业结构调整指导目录》鼓励类,其推广和应用将迎来快速增长.绿色甲醇合成工艺包含二氧化碳捕集、甲醇合成等几个单元。
(1)二氧化碳捕集
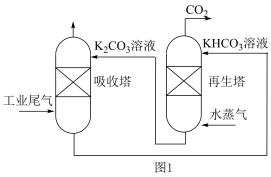
目前有多种用于工业捕集 的方法,一种模拟脱除工业尾气中
的方法,一种模拟脱除工业尾气中 的示意图如图1所示:
的示意图如图1所示:
_________ .某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
________ (该温度下 的
的 ,
, ,
, )
)
(2)合成甲醇
二氧化碳加氢制甲醇是研究的热点,其反应方程式可表示为 .
.
①向某一密闭容器中充入 和
和 ,在恒温恒压条件下发生反应,下列说法正确的是
,在恒温恒压条件下发生反应,下列说法正确的是_____________ (填选项标号);
A.达到平衡时,容器内混合气体的密度不再改变
B.反应物转化率的比值不再改变说明该反应已达到化学平衡
C.平衡时,
D.达到平衡后,充入惰性气体Ar,反应物的平衡转化率增大
②向恒压(3.0MPa)密闭装置中通入 和
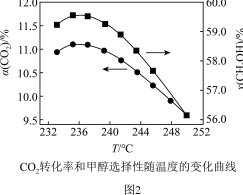
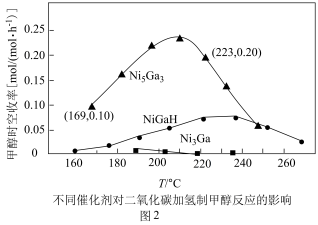
和 发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率).
发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率)._________ ;二氧化碳加氢制甲醇的速率方程可表示为 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比
______ ;
③一定温度下,将体积分数为 的进料气(含杂质气体),以
的进料气(含杂质气体),以 纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
______  (用含a的代数式表示),该反应的平衡常数
(用含a的代数式表示),该反应的平衡常数
________  (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
④反应 一般认为经过以下步骤:
一般认为经过以下步骤:
反应1:
反应2:
若反应1为慢反应,请在下图中画出上述两步反应能量变化的示意图_______ ; 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为
的电极反应方程式为_____________ 。
(1)二氧化碳捕集
目前有多种用于工业捕集
(2)合成甲醇
二氧化碳加氢制甲醇是研究的热点,其反应方程式可表示为
①向某一密闭容器中充入
A.达到平衡时,容器内混合气体的密度不再改变
B.反应物转化率的比值不再改变说明该反应已达到化学平衡
C.平衡时,
D.达到平衡后,充入惰性气体Ar,反应物的平衡转化率增大
②向恒压(3.0MPa)密闭装置中通入
③一定温度下,将体积分数为
④反应
反应1:
反应2:
若反应1为慢反应,请在下图中画出上述两步反应能量变化的示意图
2024·河北衡水·模拟预测
类题推荐
我国在2021年两会上首次将碳达峰、碳中和写人政府工作报告,力争2030年前实现碳达峰,2060年前实现碳中和。 转化利用是碳治理的重要方法,有利于实现碳资源的有效循环。
转化利用是碳治理的重要方法,有利于实现碳资源的有效循环。
已知:甲醇的气相标准燃烧热(焓): ;
;
氢气的标准燃烧热(焓): ;
;
 转化为
转化为 :
: 。
。
回答下列问题:
(1)

_______  。
。
(2)制备甲醇两种路径的势能图如图,根据势能图,下列说法正确的是_______。

(3)研究者向恒压(3.0MPa)密闭装置中通入反应物混合气[混合比例 ),测定甲醇时空收率随温度的变化曲线如图所示。(甲醇时空收率是表示单位物质的量催化剂表面甲醇的平均生成速率)。请解释甲醇时空收率“抛物线”前半段升高的原因:
),测定甲醇时空收率随温度的变化曲线如图所示。(甲醇时空收率是表示单位物质的量催化剂表面甲醇的平均生成速率)。请解释甲醇时空收率“抛物线”前半段升高的原因:_______ ,催化剂最佳配比、最佳反应温度为_______ 。
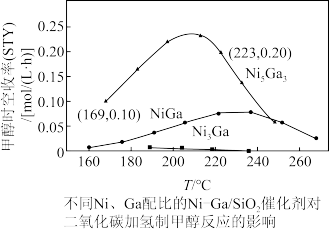
(4)二氧化碳加氢制甲醇的速率方程可表示为 ,其中k为速率常数,各物质分压的指数为反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用
,其中k为速率常数,各物质分压的指数为反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数 ,
, 反应级数不变,试计算速率常数之比
反应级数不变,试计算速率常数之比
_______ 。
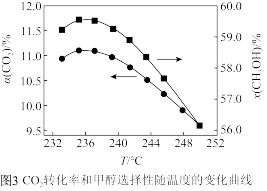
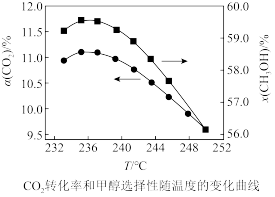
(5)在 催化加氢制甲醇过程中存在竞争性的反应产生CO:
催化加氢制甲醇过程中存在竞争性的反应产生CO:
 ,在恒温密闭容器中,维持压强和投料不变,将
,在恒温密闭容器中,维持压强和投料不变,将 和
和 按一定流速通过反应器,二氧化碳转化率和甲醇选择性
按一定流速通过反应器,二氧化碳转化率和甲醇选择性 随温度变化关系如图所示。若催化剂活性受温度影响不大,试分析235℃后图中两条曲线下降的原因:
随温度变化关系如图所示。若催化剂活性受温度影响不大,试分析235℃后图中两条曲线下降的原因:_______ 。
已知:甲醇的气相标准燃烧热(焓):
氢气的标准燃烧热(焓):
回答下列问题:
(1)
(2)制备甲醇两种路径的势能图如图,根据势能图,下列说法正确的是_______。

| A.提高 |
| B.甲酸盐路径的决速步反应是 |
| C.中间体 |
| D.使用高活性催化剂可降低反应焓变,加快反应速率 |

(4)二氧化碳加氢制甲醇的速率方程可表示为
(5)在

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网