解答题-原理综合题 较难0.4 引用1 组卷87
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)反应Ⅲ的反应热
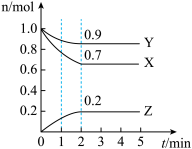
(2)向某密闭容器中投入等物质的量的
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是
A.
B.
C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3)
①平衡时
②
③
2024·陕西·模拟预测
类题推荐
研究CO2的利用对促进低碳社会的构建具有重要的意义。
I. 已知某些化学键的键能数据如下:
(1)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=____ kJ/mol (用字母表示)。
II.将燃煤废气中的CO转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
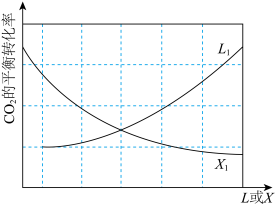
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____ 0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~ 3min内的生成速率为_________ 。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______ 。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D. CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时 CH3OCH3(g)的物质的量如下表所示:
①P3______ P2 (填“>”、“<”或“”);
②P2下,I中 CH3OCH3的平衡转化率为_______ 。
III.在一定条件下,CO2(g)+ H2(g) CO(g)+ H2O(g)。
CO(g)+ H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g) 初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____ 。向此容器中再充入CO2(g)、H2(g) 各0.5mol, 则平衡_______ (填“正向移动”、“逆向移动”或“不移动”)。
I. 已知某些化学键的键能数据如下:
| 化学键 | C=O | C-O | C-H | H-H | O-H |
| 键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=II.将燃煤废气中的CO转化为二甲醚的反应原理为:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~ 3min内的生成速率为
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D. CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时 CH3OCH3(g)的物质的量如下表所示:
| P1 | P2 | P3 | |
| I.2.0 mol CO26.0 molH2 | 0.10 mol | 0.04 mol | 0.02 mol |
| II.1.0mol CH3OCH3 3.0 mol H2O | X1 | Y1 | Z1 |
①P3
②P2下,I中 CH3OCH3的平衡转化率为
III.在一定条件下,CO2(g)+ H2(g)
 CO(g)+ H2O(g)。
CO(g)+ H2O(g)。(5)在1L密闭容器中若CO2(g)、H2(g) 初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=
近年来,碳中和、碳达峰成为热点。以 、
、 为原料生产甲醇是一种有效利用二氧化碳的途径。
为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.
II.
III.
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)若某反应的平衡常数表达式为 ,根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:
,根据反应Ⅰ-Ⅲ,请写出此反应的热化学方程式:___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: 。在一定条件下,在合成塔中充入一定量
。在一定条件下,在合成塔中充入一定量 和
和 。不同压强时,
。不同压强时, 的平衡转化率如图a所示。当气体总压强恒定为
的平衡转化率如图a所示。当气体总压强恒定为 时,平衡时各物质的物质的量分数如图b所示。
时,平衡时各物质的物质的量分数如图b所示。
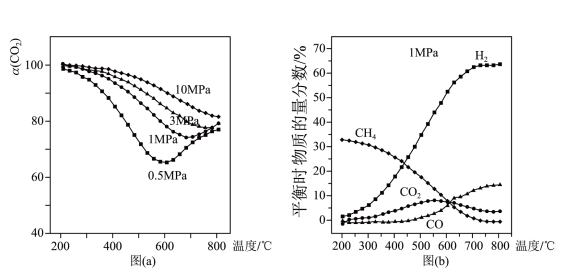
①图a中,相同温度下,压强越大, 的平衡转化率越大,其原因是
的平衡转化率越大,其原因是___________ 。
②由图b可知,
___________ 0(填“ ”、“
”、“ ”或“
”或“ ”);
”); 的物质的量分数随温度升高而增大,原因是
的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为 ),往恒容密闭容器中充入
),往恒容密闭容器中充入
 和
和
 ,发生反应I,初始压强为
,发生反应I,初始压强为 ,
, 达到平衡,压强为
达到平衡,压强为 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。
途径二:涉及的反应有
I.
II.
III.
(5)一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 发生上述反应,达到平行时,容器中
发生上述反应,达到平行时,容器中 为
为 为
为 ,反应III的平衡常数为
,反应III的平衡常数为___________ 。(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
途径一:涉及的反应有
I.
II.
III.
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时, |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
(2)若某反应的平衡常数表达式为
(3)工业中,对于反应I,通常同时存在副反应IV:

①图a中,相同温度下,压强越大,
②由图b可知,
(4)在一定条件下(温度为
途径二:涉及的反应有
I.
II.
III.
(5)一定条件下,向体积为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网