解答题-实验探究题 较难0.4 引用1 组卷72
Ⅰ.制备
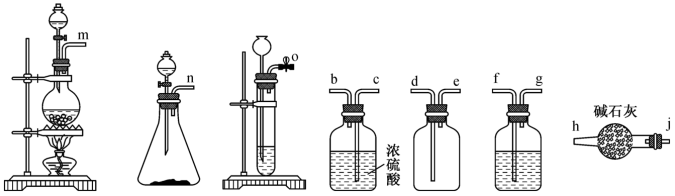
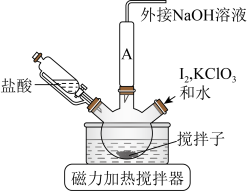
ⅰ.如图连接装置,向三颈烧瓶中依次加入
ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定
ⅳ.称取
ⅴ.移取
ⅵ.做空白实验,平均消耗标准液体积
回答下列问题:
(1)装置中A处应安装的仪器为
A.
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为
(3)步骤ⅰ中,生成
(4)步骤ⅱ中,能够生成
(5)步骤ⅲ中,醇洗的目的是
(6)步骤ⅴ中,滴加的指示剂为
(7)
2024·陕西·模拟预测
类题推荐
【小题1】苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
 +KnMO4
+KnMO4
 +MnO2
+MnO2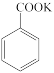 +HCl
+HCl
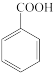 +KCl
+KCl
实验步骤:
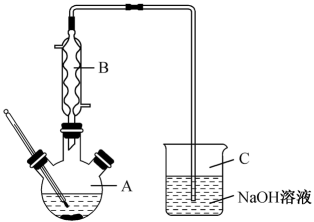
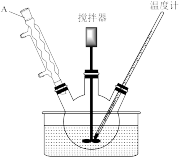
步骤1:在如图所示装置的三颈烧瓶中,加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热至反应完全。
步骤2:停止加热,继续搅拌,冷却片刻后,慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣(MnO2)。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量___ 洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
步骤3:纯度测定:称取0.1220g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,加入指示剂,用0.01000mol·L-1的KOH标准溶液滴定,三次滴定平均消耗22.30mL的KOH标准溶液。
回答下列问题:
(1)步骤1中,如图所示的装置中仪器A的名称是___________ ,作用是___________ 。
(2)加入适量饱和亚硫酸氢钠溶液的目的是(用离子方程式表示)___________ 。
(3)步骤2中,将析出的苯甲酸过滤,用少量___________ 洗涤。
(4)干燥苯甲酸晶体时,若温度过高,可能出现的结果是___________ 。
(5)步骤3中滴定时用的指示剂最好是___________。
(6)本实验制备的苯甲酸的纯度为____ (保留4位有效数字)
(7)若要得到纯度更高的苯甲酸,可通过在水中____ (填操作名称)的方法提纯。
 +KnMO4
+KnMO4 +MnO2
+MnO2 +HCl
+HCl +KCl
+KCl| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g·mL-1) | 溶解性 |
| 甲苯 | 92 | -95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
步骤1:在如图所示装置的三颈烧瓶中,加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热至反应完全。

步骤2:停止加热,继续搅拌,冷却片刻后,慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣(MnO2)。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量
步骤3:纯度测定:称取0.1220g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,加入指示剂,用0.01000mol·L-1的KOH标准溶液滴定,三次滴定平均消耗22.30mL的KOH标准溶液。
回答下列问题:
(1)步骤1中,如图所示的装置中仪器A的名称是
(2)加入适量饱和亚硫酸氢钠溶液的目的是(用离子方程式表示)
(3)步骤2中,将析出的苯甲酸过滤,用少量
(4)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
(5)步骤3中滴定时用的指示剂最好是___________。
| A.石蕊试液 | B.酚酞试液 | C.甲基橙溶液 | D.淀粉溶液 |
(7)若要得到纯度更高的苯甲酸,可通过在水中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网