解答题-原理综合题 较难0.4 引用1 组卷43
工业合成氨是人类科学技术的一项重大突破,我国目前氨的生产能力位居世界首位。合成氨反应为 。回答下列问题:
。回答下列问题:
(1)已知 和
和 的燃烧热(
的燃烧热( )分别为
)分别为 和
和 ,则合成氨反应的
,则合成氨反应的
_______ ;合成氨反应的逆过程能自发进行的最低温度为_______  。
。
(2)在合成氨过程中,需要不断分离出氨的原因为_______ (填字母)。
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(3)某温度下,在容积为 的恒容密闭容器中模拟工业合成氨,充入
的恒容密闭容器中模拟工业合成氨,充入 和
和 的总物质的量为
的总物质的量为 ,容器内起始压强为标准压强
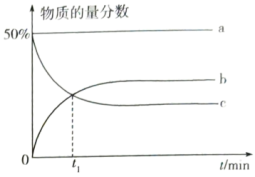
,容器内起始压强为标准压强 ,容器内各组分的物质的量分数与反应时间
,容器内各组分的物质的量分数与反应时间 的关系如图所示:
的关系如图所示:_______ (填物质名称)的物质的量分数的变化情况。
② 内,平均反应速率
内,平均反应速率
_______  。
。
③达平衡时容器内压强为 ,则标准平衡常数
,则标准平衡常数
_______ [对于反应 ,标准平衡常数
,标准平衡常数 ,其中
,其中 为标准压强,
为标准压强, 、
、 、
、 、
、 为各组分的平衡分压,分压
为各组分的平衡分压,分压 总压
总压 物质的量分数]。
物质的量分数]。
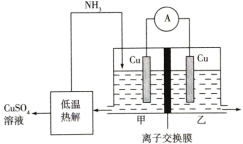
(4)利用热再生氨电池可实现 电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的
电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的 电镀废液,向甲室中加入足量氨气后电池开始工作。
电镀废液,向甲室中加入足量氨气后电池开始工作。_______ 。
②理论上每转移 电子,乙室中溶液的质量变化为
电子,乙室中溶液的质量变化为_______ g。
(1)已知
(2)在合成氨过程中,需要不断分离出氨的原因为
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(3)某温度下,在容积为
②
③达平衡时容器内压强为
(4)利用热再生氨电池可实现
②理论上每转移
2024·河南安阳·三模
类题推荐
氯氨是常用的饮用水消毒剂,是氯气遇到氨气反应生成的一类化合物,主要包括一氯胺、二氯胺和三氯胺( 、
、 和
和 ),回答下列问题:
),回答下列问题:
(1)①工业上可利用反应 制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的
制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的
_______ 。
②一氯胺是重要的水消毒剂,原因是一氯胺在中性环境中会发生水解,生成具有强烈杀菌消毒作用的物质,该反应的化学方程式_______ 。
(2)用 和
和 反应制备二氯胺的方程式为
反应制备二氯胺的方程式为 ,向容积均为
,向容积均为 的甲
的甲 、乙
、乙 的两个容器中分别加入
的两个容器中分别加入 和
和 ,测得各容器中
,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
①甲容器中, 内用
内用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率
_______ 。
②该反应的
_______ 0(填“>”或“<”)。
③对该反应,下列说法正确的是_______ (填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内 和
和 物质的量之比不变,则表明反应达到平衡状态
物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后其他条件不变,充入一定量氦气, 的转化率增大
的转化率增大
D.反应达到平衡后其他条件不变,加入一定量的 ,平衡向逆反应方向移动
,平衡向逆反应方向移动
(3)恒温条件下, 和
和 发生反应
发生反应 ,测得平衡时
,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
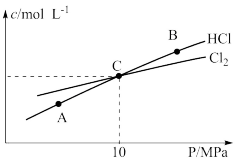
①A、B、C三点中 转化率最高的是
转化率最高的是_______ 点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数
_______  (
( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(1)①工业上可利用反应
| 化学键 | ||||
| 键能 | 391 | 243 | 191 | 431 |
(2)用
| 0 | 40 | 80 | 120 | 160 | |
| 2.00 | 1.50 | 1.10 | 0.80 | 0.80 | |
| 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的
③对该反应,下列说法正确的是
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内
C.反应达到平衡后其他条件不变,充入一定量氦气,
D.反应达到平衡后其他条件不变,加入一定量的
(3)恒温条件下,

①A、B、C三点中
②计算C点时该反应的压强平衡常数
我国提出了碳达峰、碳中和的目标,控制大气中的 浓度,减缓温室效应,将
浓度,减缓温室效应,将 转化为高附加值化工产品成为当前科技工作者的一个重要课题。回答下列问题:
转化为高附加值化工产品成为当前科技工作者的一个重要课题。回答下列问题:

(1)工业生产尿素的基本原料为 ,反应历程中的能量变化如图所示(反应历程中的有关物质均为气态)。写出制备尿素的热化学方程式:
,反应历程中的能量变化如图所示(反应历程中的有关物质均为气态)。写出制备尿素的热化学方程式:_______ 。
利用 和
和 合成甲醇,在催化剂作用下可发生如下两个平行反应:
合成甲醇,在催化剂作用下可发生如下两个平行反应:
反应Ⅰ:
反应Ⅱ:
(2)一定温度下,向恒容密闭容器中充入 和
和 ,在催化剂作用下发生反应,容器内气体压强随时间的变化如表所示。
,在催化剂作用下发生反应,容器内气体压强随时间的变化如表所示。
该温度下,若平衡时 的体积分数为
的体积分数为 ,反应Ⅱ的平衡常数
,反应Ⅱ的平衡常数
_______ ( 为以分压表示的平衡常数,以各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
为以分压表示的平衡常数,以各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
(3)下列说法不正确的是_______。
(4)一定比例的合成气在装有催化剂的反应器中反应 ,体系中甲醇的产率与温度的关系如下图所示,此温度范围内,催化剂活性不受影响。
,体系中甲醇的产率与温度的关系如下图所示,此温度范围内,催化剂活性不受影响。

①当温度高于 后,甲醇产率减小的原因可能是
后,甲醇产率减小的原因可能是_______ 。
②请在图中画出甲醇平衡产率随温度变化的曲线图_______ 。

(1)工业生产尿素的基本原料为
利用
反应Ⅰ:
反应Ⅱ:
(2)一定温度下,向恒容密闭容器中充入
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| 压强 | 320 | 280 | 250 | 226 | 206 | 200 | 200 |
(3)下列说法不正确的是_______。
| A.从反应体系中分离出甲醇,有利于提高反应物的转化率 |
| B.向容器中按原比例再充入反应物,达到新平衡时各组分的体积分数不变 |
| C.当 |
| D.工业合成甲醇时,将气体以一定流速通过催化剂,选择合适催化剂可提高甲醇的平衡产率 |
(4)一定比例的合成气在装有催化剂的反应器中反应

①当温度高于
②请在图中画出甲醇平衡产率随温度变化的曲线图
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网






