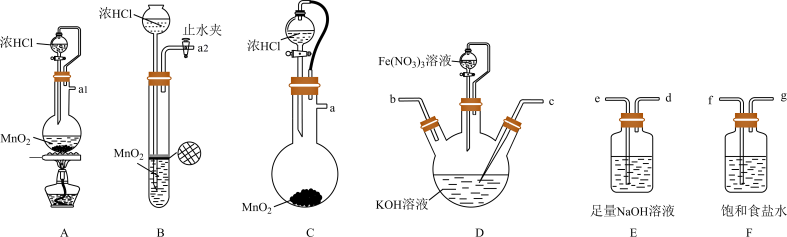
解答题-工业流程题 较难0.4 引用1 组卷80
高铁酸钾( )是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾(
)是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾( )可用于自来水杀菌消毒和净化,一种由磁铁矿(主要成份为
)可用于自来水杀菌消毒和净化,一种由磁铁矿(主要成份为 ,还含有少量的MgO、
,还含有少量的MgO、 、
、 等)制备高铁酸钾的过程如下图所示:
等)制备高铁酸钾的过程如下图所示: )难溶于醇等有机溶剂。
)难溶于醇等有机溶剂。
②25℃部分难溶物的溶度积如下:
回答下列问题:
(1)酸溶后得到的滤渣的主要成分___________ 。
(2)加入 氧化过程主要发生的离子方程式
氧化过程主要发生的离子方程式___________ ,
 的用量远大于理论值,原因可能是
的用量远大于理论值,原因可能是___________ 。
(3)滤液1中含有的主要金属阳离子为___________ 。
(4)氧化过滤过程产生 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ ,根据制备过程可知,该温度下
___________  (填“<”或“>”)。
(填“<”或“>”)。
(5) 粗产品含有
粗产品含有 、KCl等杂质,用
、KCl等杂质,用___________ 方法进行分离提纯。其提纯步骤为:将一定量的 粗产品溶于冷的3 mol/L KOH溶液中过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用
粗产品溶于冷的3 mol/L KOH溶液中过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用___________ (填字母)。
a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(6)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:



现称取a g高铁酸钾( )(摩尔质量为M g/mol)样品溶于过量的碱性亚铬酸盐
)(摩尔质量为M g/mol)样品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在250 mL容量瓶中定容,每次取25.00 mL于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c mol/L
溶液中,充分反应后过滤,滤液在250 mL容量瓶中定容,每次取25.00 mL于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c mol/L 标准溶液滴定至终点,消耗标准溶液V mL。该产品中高铁酸钾(
标准溶液滴定至终点,消耗标准溶液V mL。该产品中高铁酸钾( )的纯度为
)的纯度为___________ %。
②25℃部分难溶物的溶度积如下:
(1)酸溶后得到的滤渣的主要成分
(2)加入
(3)滤液1中含有的主要金属阳离子为
(4)氧化过滤过程产生
(5)
a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(6)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
现称取a g高铁酸钾(
2024·陕西西安·三模
类题推荐
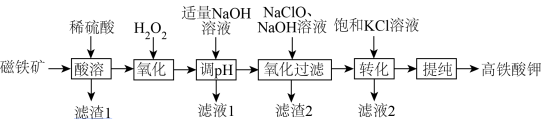
高铁酸钾 是一种紫黑色固体,在碱性、低温条件下较稳定,在中性或酸性溶液中易发生反应,能释放大量的氧气,同时自身被还原产生一种絮凝剂,因此成为一种集氧化、吸附、杀菌、脱色、除臭为一体的高效绿色水处理剂。
是一种紫黑色固体,在碱性、低温条件下较稳定,在中性或酸性溶液中易发生反应,能释放大量的氧气,同时自身被还原产生一种絮凝剂,因此成为一种集氧化、吸附、杀菌、脱色、除臭为一体的高效绿色水处理剂。
I.制备
(1)写出高铁酸钾溶于水中发生反应的离子方程式_______ 。
(2)①中合成 的离子方程式是
的离子方程式是_______ 。
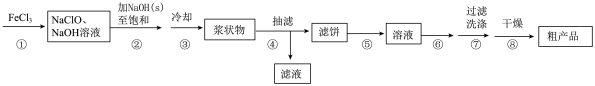
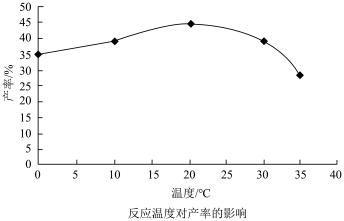
(3)①中合成 时,相同时间内产率受温度影响记录如图,产率曲线产生如图变化的可能原因是
时,相同时间内产率受温度影响记录如图,产率曲线产生如图变化的可能原因是_______ 。
(4)操作②的目的是_______ 。
(5)已知高铁酸根在苛性钠溶液中的溶解度大于在苛性钾溶液中,则步骤⑤、⑥选择的试剂分别可能是_______。
II.产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
①
②
③
(6)写出基态 的价电子排布式
的价电子排布式_______ 。
(7)现称取 (摩尔质量为
(摩尔质量为 )粗产品溶于过量的碱性亚铬酸盐
)粗产品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在
溶液中,充分反应后过滤,滤液在 容量瓶中定容。每次取
容量瓶中定容。每次取 于锥形瓶中加入稀硫酸酸化,用
于锥形瓶中加入稀硫酸酸化,用 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。该粗产品中
。该粗产品中 的质量分数为
的质量分数为_______ (用含a、c、V、M的代数式表示)。若滴定管只用蒸馏水洗涤而未用标准液润洗,则测得的结果_______ (填“偏高”偏低”或“无影响”)。
I.制备

(1)写出高铁酸钾溶于水中发生反应的离子方程式
(2)①中合成
(3)①中合成

(4)操作②的目的是
(5)已知高铁酸根在苛性钠溶液中的溶解度大于在苛性钾溶液中,则步骤⑤、⑥选择的试剂分别可能是_______。
| A.饱和 |
| B.一定浓度的 |
| C.饱和 |
| D.一定浓度的 |
II.产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
①
②
③
(6)写出基态
(7)现称取
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网