解答题-实验探究题 适中0.65 引用1 组卷71
某学习小组在实验室模拟工业制备硫氰化钾并测定产品中KSCN的含量。制备原理:
 (反应较缓慢)、
(反应较缓慢)、 。
。
已知: 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 ;
; 在300℃左右分解。具体步骤如下:
在300℃左右分解。具体步骤如下:
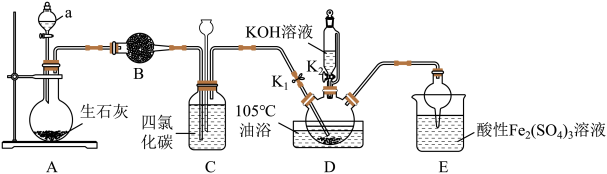
Ⅰ.连接实验仪器,并检查装置的气密性。
Ⅱ.称取氯化铵、消石灰,经系列操作,将产生的气体通过碱石灰干燥。
Ⅲ.将干燥后的气体缓缓通入盛有 、
、 和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
Ⅳ.移开水浴,将三颈烧瓶继续加热至105℃,一段时间后,缓缓滴入适量的KOH溶液并继续保持液温105℃。
Ⅴ.过滤三颈烧瓶中的混合物,将滤液蒸发浓缩、冷却结晶,再过滤、洗涤、干燥,得到KSCN晶体。
回答下列问题:
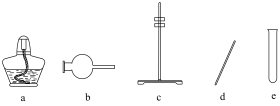
(1)步骤Ⅱ中用到的部分实验仪器如下:_______ ,“系列操作”中,为加快制备气体速率而进行的操作为_______ 。
(2)步骤Ⅲ中,“加热较长时间”的原因是_______ 。
(3)步骤Ⅳ中,将三颈烧瓶继续加热至105℃一段时间,该过程中发生反应的化学方程式为_____ ,实验时需将三颈烧瓶中逸出的尾气进行处理,下列试剂中最合适的是_______ (填标号)。
A.饱和食盐水 B.酸性 溶液 C.饱和NaHS溶液
溶液 C.饱和NaHS溶液
(4)步骤Ⅴ中,第一次过滤的目的是_______ 。
(5)测定晶体中KSCN的含量:称取4.0g样品,配成250mL溶液。量取75.00mL溶液并加入适量稀硝酸调节pH,再加入几滴 溶液,然后将溶液等分成三份,用0.1000mol/L
溶液,然后将溶液等分成三份,用0.1000mol/L  标准溶液分别滴定,达到滴定终点时平均消耗24.00mL
标准溶液分别滴定,达到滴定终点时平均消耗24.00mL  溶液。
溶液。
①滴定时发生的反应: (白色)。则判断到达滴定终点的现象是
(白色)。则判断到达滴定终点的现象是________ 。
②晶体中KSCN的质量分数为_______ %(计算结果保留1位小数)。
已知:
Ⅰ.连接实验仪器,并检查装置的气密性。
Ⅱ.称取氯化铵、消石灰,经系列操作,将产生的气体通过碱石灰干燥。
Ⅲ.将干燥后的气体缓缓通入盛有
Ⅳ.移开水浴,将三颈烧瓶继续加热至105℃,一段时间后,缓缓滴入适量的KOH溶液并继续保持液温105℃。
Ⅴ.过滤三颈烧瓶中的混合物,将滤液蒸发浓缩、冷却结晶,再过滤、洗涤、干燥,得到KSCN晶体。
回答下列问题:
(1)步骤Ⅱ中用到的部分实验仪器如下:
(2)步骤Ⅲ中,“加热较长时间”的原因是
(3)步骤Ⅳ中,将三颈烧瓶继续加热至105℃一段时间,该过程中发生反应的化学方程式为
A.饱和食盐水 B.酸性
(4)步骤Ⅴ中,第一次过滤的目的是
(5)测定晶体中KSCN的含量:称取4.0g样品,配成250mL溶液。量取75.00mL溶液并加入适量稀硝酸调节pH,再加入几滴
①滴定时发生的反应:
②晶体中KSCN的质量分数为
2024·四川·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网