解答题-原理综合题 较难0.4 引用3 组卷230
Ⅰ:
Ⅱ:
回答下列问题:
(1)物质的标准生成焓是指在标态和某温度下,由元素最稳定的单质生成1mol纯净物时的焓变。一些物质298K时的标准生成焓(
物质 | |||||
| -74.8 | -110 | -393.5 | -286 | 0 |
(2)有利于提高CO平衡产率的条件是______(填标号)。
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(3)反应Ⅰ的正、逆反应速率方程为:
(5)在101kPa时,工业上按投料
2024·山东菏泽·二模
类题推荐
“碳达峰、碳中和”是我国社会发展重大战略之一, 的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用
的综合利用是实现“碳达峰、碳中和”的有效途径,以下为常见的两种利用 的方法。
的方法。
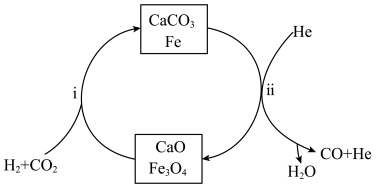
方法I: 加氢制备合成气
加氢制备合成气
在一定温度、压强为 条件下,
条件下, 和
和 按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
按照1:1投料,反应经图所示过程,可实现二氧化碳的高效转化。
相关化学键的键能数据如下表:
(1)该反应的热化学方程式为
 ,则
,则
______ 。
(2)有关该反应的说法错误的是_______(填标号)。
(3)反应i达到平衡后通入 ,有利于反应ii的进行,结合平衡移动原理,解释原因
,有利于反应ii的进行,结合平衡移动原理,解释原因_____________________________________________ 。
方法II: 重整制备合成气
重整制备合成气
 重整制备合成气时发生的反应主要有:
重整制备合成气时发生的反应主要有:
主反应:

副反应:
(4)在一定条件下,向 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 ,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
,只发生主反应,测得平衡时压强变为原来的1.5倍,则该反应的平衡常数
__________  。
。
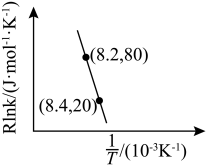
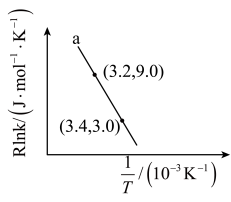
(5)主反应的反应速率 ,
, ,
, 符合阿伦尼乌斯公式
符合阿伦尼乌斯公式 (Ea为活化能、T为温度,R、C为常数),实验测得
(Ea为活化能、T为温度,R、C为常数),实验测得 的实验数据如图所示,则该反应正反应的活化能为
的实验数据如图所示,则该反应正反应的活化能为
________  ,升高温度时,
,升高温度时,
_____ (填“增大”、“减小”或“不变”)。
(6)一定条件下重整反应中会因发生副反应产生积碳而导致催化剂活性降低,若向容器中通入过量水蒸气可以清除积碳,反应的化学方程式为__________ , 的值
的值__________ (填“增大”、“减小”或“不变”)。
方法I:
在一定温度、压强为
相关化学键的键能数据如下表:

化学键 | ||||
键能E/( | 745 | a | 1046 | 436 |
(1)该反应的热化学方程式为
(2)有关该反应的说法错误的是_______(填标号)。
| A.当装置内的气体压强不变时,反应达到平衡状态 |
| B.若在反应中能及时分离出 |
| C.反应ii的总反应为 |
| D.选择合适的催化剂会提高平衡时 |
(3)反应i达到平衡后通入
方法II:
主反应:
副反应:
(4)在一定条件下,向
(5)主反应的反应速率

(6)一定条件下重整反应中会因发生副反应产生积碳而导致催化剂活性降低,若向容器中通入过量水蒸气可以清除积碳,反应的化学方程式为
研究碳、氮及其化合物气体的相关反应对治理大气污染、建设生态文明具有重要意义。在一定条件下焦炭可以还原 ,反应为:
,反应为: 。
。
(1)已知:一定条件下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓( )。
)。
则

___________ kJ/mol
(2)在恒温恒容的密闭容器中进行该反应,达到平衡状态后,若从反应体系中分离出 ,则下列说法正确的是___________。
,则下列说法正确的是___________。
(3)在一定体积的密闭容器中,该反应的化学平衡常数K和温度t的关系如下:
回答下列问题:
①某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为___________ ℃。
②800℃时发生上述反应,某一时刻测得容器内物质的浓度分别为: 为4.5 mol/L,
为4.5 mol/L, 为1.5 mol/L,
为1.5 mol/L, 为3 mol/L,则此时反应向
为3 mol/L,则此时反应向___________ (填“正反应方向”或“逆反应方向”)进行。
(4)有人利用反应 对
对 进行吸附。在T℃下,将
进行吸附。在T℃下,将
 的混合气体以一定流速通过填充有碳粉的反应器,在不同压强下,相同时间内
的混合气体以一定流速通过填充有碳粉的反应器,在不同压强下,相同时间内 的转化率与压强的关系如图所示。
的转化率与压强的关系如图所示。
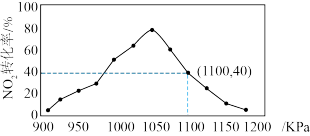
①图中曲线呈现先升高后降低的变化,出现该变化趋势的原因是___________ 。
②在T℃、1100 KPa时,已知混合气体通过反应器的时间为9 s,请计算 分压的平均变化率为
分压的平均变化率为___________ KPa·s-1(气体分压=气体总压×体积分数;结果保留两位小数)。
(1)已知:一定条件下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓(
| 物质 | ||||
| 生成焓 | +33.2 | 0 | 0 | -393.5 |
(2)在恒温恒容的密闭容器中进行该反应,达到平衡状态后,若从反应体系中分离出
| A.平衡正向移动 | B.平衡逆向移动 |
| C.逆反应速率先减小后增大 | D. |
(3)在一定体积的密闭容器中,该反应的化学平衡常数K和温度t的关系如下:
| t℃ | 500 | 600 | 700 | 800 | 1000 |
| K | 2.6 | 1.9 | 1.0 | 0.7 | 0.4 |
①某温度下,平衡浓度符合下式:
②800℃时发生上述反应,某一时刻测得容器内物质的浓度分别为:
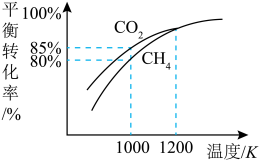
(4)有人利用反应

①图中曲线呈现先升高后降低的变化,出现该变化趋势的原因是
②在T℃、1100 KPa时,已知混合气体通过反应器的时间为9 s,请计算
研究碳、氮及其化合物气体的相关反应对治理大气污染、建设生态文明具有重要意义。
在一定条件下焦炭可以还原 ,反应为:
,反应为: 。
。
(1)已知:一定条件下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓( )。
)。
则
_______ kJ/mol
(2)再恒温恒容的密闭容器中进行该反应,达到平衡状态后,若从反应体系中分离出 ,则在平衡移动过程中_______。
,则在平衡移动过程中_______。
(3)在一定体积的密闭容器中,该反应的化学平衡常数K和温度t的关系如下:
回答下列问题:
①某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______ ℃。
②800℃时发生上述反应,某一时刻测得容器内物质的浓度分别为: 为4.5mol/L,
为4.5mol/L, 为1.5mol/L,
为1.5mol/L, 为3mol/L,则此时反应向
为3mol/L,则此时反应向_______ (填“正反应方向”或“逆反应方向”)进行。
(4)有人利用反应 对
对 进行吸附。在T℃下,将
进行吸附。在T℃下,将 的混合气体以一定流速通过填充有碳粉的反应器,在不同压强下,相同时间内
的混合气体以一定流速通过填充有碳粉的反应器,在不同压强下,相同时间内 的转化率与压强的关系如图所示。
的转化率与压强的关系如图所示。

①图中曲线呈现先升高后降低的变化,其降低的原因是_______ ,其升高的原因是_______ 。
②在T℃、 时,已知混合气体通过反应器的时间为9s,请计算
时,已知混合气体通过反应器的时间为9s,请计算 分压的平均变化率为
分压的平均变化率为_______  (气体分压=气体总压×体积分数:保留两位小数)。
(气体分压=气体总压×体积分数:保留两位小数)。
在一定条件下焦炭可以还原
(1)已知:一定条件下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓(
| 物质 | ||
| 生成焓 | +33.2 | -393.5 |
则
(2)再恒温恒容的密闭容器中进行该反应,达到平衡状态后,若从反应体系中分离出
| A.K值减小 | B.逆反应速率先减小后增大 |
| C.K值增大 | D.正反应速率减小先慢后快 |
| 500 | 600 | 700 | 800 | 1000 | |
| K | 2.6 | 1.9 | 1.0 | 0.7 | 0.4 |
回答下列问题:
①某温度下,平衡浓度符合下式:
②800℃时发生上述反应,某一时刻测得容器内物质的浓度分别为:
(4)有人利用反应

①图中曲线呈现先升高后降低的变化,其降低的原因是
②在T℃、
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


