解答题-实验探究题 较难0.4 引用1 组卷132
某小组以粗铍(含少量的 、
、 、
、 、
、 、
、 等)为原料制备、提纯
等)为原料制备、提纯  ,并测定产品中
,并测定产品中 的含量。
的含量。
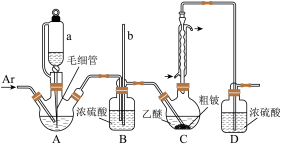
Ⅰ.按如图所示装置(夹持装置略)制
已知:①乙醚沸点为34.5℃;BeCl2溶于乙醚,不溶于苯,易发生水解; 溶于乙醚和苯;
溶于乙醚和苯; 、
、 不溶于乙醚和苯。
不溶于乙醚和苯。
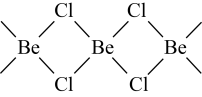
② 与
与  的化学性质相似。
的化学性质相似。 ,仪器
,仪器 的名称为
的名称为___________ ;装置D的作用是___________ 。
(2)C中发生的主要反应的化学方程式为___________ 。
(3)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是___________ 。
(4)上述实验装置的缺点是___________ 。
Ⅱ. 提纯
反应后,装置 中
中 的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得
的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得 产品。
产品。
(5)用苯溶解固体,充分搅拌后过滤,目的是___________ 。
Ⅲ.测定产品中 的含量
的含量
取 产品溶于盐酸配成
产品溶于盐酸配成 溶液;取
溶液;取 溶液,加入
溶液,加入 掩蔽杂质离子,调节,过滤、洗涤,得
掩蔽杂质离子,调节,过滤、洗涤,得 固体,加入
固体,加入  溶液溶解固体,滴加酚酞作指示剂,用
溶液溶解固体,滴加酚酞作指示剂,用 盐酸溶液滴定其中的
盐酸溶液滴定其中的 ,消耗盐酸
,消耗盐酸 。(已知:
。(已知: ;滴定过程中
;滴定过程中 、
、 不与盐酸反应)
不与盐酸反应)
(6)调节溶液 时要控制
时要控制 不能过大,其原因为
不能过大,其原因为___________ 。
(7) 的纯度为
的纯度为___________ 。
(8)某同学认为该计算结果不可靠,理由是___________ 。
Ⅰ.按如图所示装置(夹持装置略)制
已知:①乙醚沸点为34.5℃;BeCl2溶于乙醚,不溶于苯,易发生水解;
②
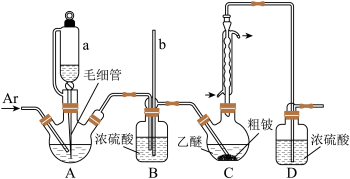
(2)C中发生的主要反应的化学方程式为
(3)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是
(4)上述实验装置的缺点是
Ⅱ. 提纯
反应后,装置
(5)用苯溶解固体,充分搅拌后过滤,目的是
Ⅲ.测定产品中
取
(6)调节溶液
(7)
(8)某同学认为该计算结果不可靠,理由是
2024·天津滨海新·三模
类题推荐
硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1),已知它易溶于水,难溶于乙醇,在40~50℃熔化,48℃分解。某兴趣小组用两种方法制取硫代硫酸钠晶体并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是___________ 。
(2)下列说法不正确的是 ___________。
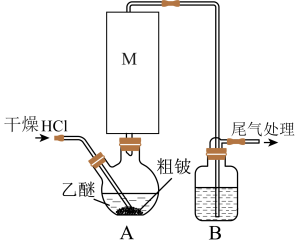
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称___________ 。
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为___________ 。
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 ___________ 。
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①出“步骤2”中反应的离子方程式___________ 。
②试计算Na2S2O3·5H2O的纯度___________ 。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是
(2)下列说法不正确的是 ___________。
| A.蒸发浓缩至溶液表面出现大量沉淀时,停止加热 |
| B.快速冷却,可析出较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.反应后趁热过滤是除去硫等不溶物 |
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O
①出“步骤2”中反应的离子方程式
②试计算Na2S2O3·5H2O的纯度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网