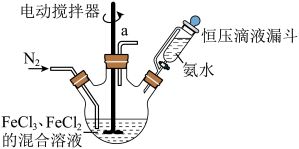
解答题-实验探究题 适中0.65 引用1 组卷28
某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品,钒基固溶体合金是一类重要的贮氢材料。制备共沉淀物的装置如下图:_______ 、_______ 、_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是_______ 。
(3)制备VO2+时,用草酸将 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为_______ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是_______ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为_______ 。
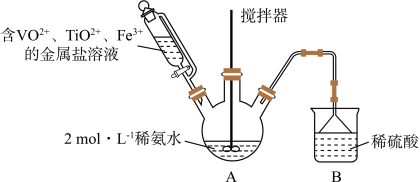
(2)装置C中支管插入三颈烧瓶中的作用是
(3)制备VO2+时,用草酸将
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为
2020·贵州安顺·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网