解答题-实验探究题 较难0.4 引用2 组卷247
二氧化氯 是一种绿色氧化剂,可作漂白剂和饮用水消毒剂。
是一种绿色氧化剂,可作漂白剂和饮用水消毒剂。 易溶于水(相同条件下,
易溶于水(相同条件下, 在水中的溶解度约为
在水中的溶解度约为 的5倍,
的5倍, 与水的反应可忽略)。某兴趣小组采用如下装置制备,原理为:
与水的反应可忽略)。某兴趣小组采用如下装置制备,原理为: 。
。
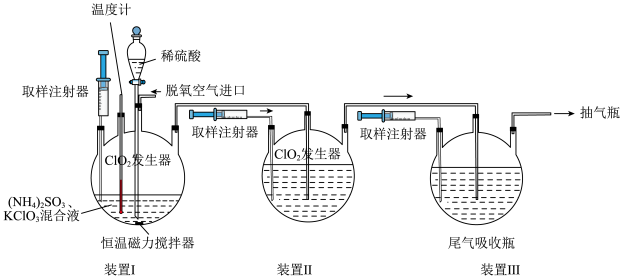
(1)装稀硫酸的仪器的名称是________ 。
(2)抽气泵作用是:①抽入空气稀释 气体;②
气体;②________ 。
(3) 在水中的溶解度大于
在水中的溶解度大于 的原因是
的原因是________ 。
(4)已知: 、
、 被
被 还原的程度随pH的不同而变化,具体情况如下:①
还原的程度随pH的不同而变化,具体情况如下:① ;②
;② 。取装置II中的溶液1.00mL,稀释至20.00mL,加过量KI后用
。取装置II中的溶液1.00mL,稀释至20.00mL,加过量KI后用 标准溶液滴定,消耗标准液amL。将滴定后溶液用稀硫酸调溶液pH至
标准溶液滴定,消耗标准液amL。将滴定后溶液用稀硫酸调溶液pH至 ,补加KI且除酸后再次滴定,又消耗
,补加KI且除酸后再次滴定,又消耗 标准溶液bmL(注:两次滴定均只发生反应
标准溶液bmL(注:两次滴定均只发生反应 )。求
)。求 纯度
纯度
________ (用含a、b的式子表示)。
(5)装置III中可加入的试剂有________(填序号)。
(6)下列说法不正确 的是________(填序号)。
(1)装稀硫酸的仪器的名称是
(2)抽气泵作用是:①抽入空气稀释
(3)
(4)已知:
(5)装置III中可加入的试剂有________(填序号)。
| A.饱和食盐水 | B. |
| C.NaOH和 | D. |
(6)下列说法
| A.垫上石棉网,用酒精灯煮沸装置I内溶液以加快反应 |
| B.抽气泵的抽气速率对 |
| C.待装置II的进气管中不再产生气泡,再关闭抽气泵 |
| D.冷却装置I中反应后的溶液,得到的晶体可作化肥 |
2024·浙江·三模
类题推荐
碘酸钙是一种无机精细与专用化学品。一种制备并测定六水合碘酸钙含量的实验设计如下:
已知:碘酸钙为白色固体,微溶于水。
步骤I:碘酸氢钾( )的制备
)的制备
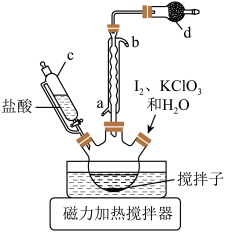
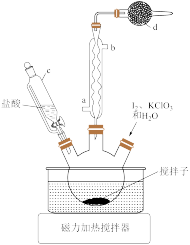
在三颈烧瓶中加入2.54g碘、2.60g氯酸钾和50mL水,滴加 的盐酸至pH=1,控制温度85℃左右,装置如图所示。
的盐酸至pH=1,控制温度85℃左右,装置如图所示。
步骤II:碘酸钙晶体 的制备将反应后溶液转入烧杯中,加入X溶液,调节pH=10.滴加11mL
的制备将反应后溶液转入烧杯中,加入X溶液,调节pH=10.滴加11mL 溶液,充分反应后用冰水冷却,抽滤、洗涤、晾干,得粗产品碘酸钙晶体4.50g。
溶液,充分反应后用冰水冷却,抽滤、洗涤、晾干,得粗产品碘酸钙晶体4.50g。
步骤III:产品中碘酸钙晶体含量测定
①准确称取1.2000g粗产品,置于烧杯中,加入20mL 溶解样品,转移到250mL容量瓶定容。量取25.00mL溶液于碘量瓶中,加入稍过量的KI,然后用
溶解样品,转移到250mL容量瓶定容。量取25.00mL溶液于碘量瓶中,加入稍过量的KI,然后用 溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去25.24mL标准溶液(
溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去25.24mL标准溶液(
 )。
)。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗0.04mL 标准溶液。
标准溶液。
请回答下列问题:
(1)仪器c的名称为_______ 。干燥管d中的试剂是_______ 。
(2)步骤I中有黄绿色气体产生,制备 反应的化学方程式为
反应的化学方程式为_______ 。
(3)步骤I中温度不宜过高的原因是_______ ,判断反应结束的实验现象是_______ 。
(4)步骤II中X溶液是_______ 。
(5)碘酸钙晶体中 的纯度为
的纯度为_______ (保留两位小数)。
(6)下列有关该实验的叙述正确的是_______。
已知:碘酸钙为白色固体,微溶于水。
步骤I:碘酸氢钾(
在三颈烧瓶中加入2.54g碘、2.60g氯酸钾和50mL水,滴加

步骤II:碘酸钙晶体
步骤III:产品中碘酸钙晶体含量测定
①准确称取1.2000g粗产品,置于烧杯中,加入20mL
②空白实验:不取产品,其余试剂用量和步骤相同,消耗0.04mL
请回答下列问题:
(1)仪器c的名称为
(2)步骤I中有黄绿色气体产生,制备
(3)步骤I中温度不宜过高的原因是
(4)步骤II中X溶液是
(5)碘酸钙晶体中
(6)下列有关该实验的叙述正确的是_______。
| A.步骤I中球形冷凝管的冷水进口为b |
| B.步骤II中用冰水冷却有利于碘酸钙晶体析出 |
| C.步骤III中空白实验的主要目的是排除空气中 |
| D.本实验中制得的 |
某兴趣小组用二氧化锰(MnO2)和草酸晶体(H2C2O4•2H2O)为原料制备碳酸锰(MnCO3),按如图流程开展了实验: 
已知:①碳酸锰几乎不溶于水,不溶于醇,溶于稀无机酸;受热易分解。
②Mn(Ⅳ)在酸性条件下易被还原为Mn(Ⅱ),Mn(Ⅱ)在碱性条件下易被氧化为Mn(Ⅳ)。
请回答:
(1)加入稀硫酸的作用是____ 。
(2)步骤Ⅰ:反应的离子方程式是____ 。
(3)下列操作中正确的是____ 。
(4)步骤Ⅳ抽滤、洗涤操作可用如图装置进行,打开活塞K,打开抽气泵,转移固液混合物,关闭活塞K,确认抽干,进行洗涤。请给出洗涤的操作排序(洗涤操作只需考虑一次):a→c→(____)→(____)→(____)→(____)→将产品转至干燥器。____
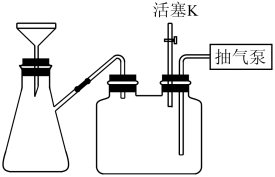
a.打开活塞K b.关闭活塞K c.加洗涤剂洗涤 d.打开抽气泵 e.关闭抽气泵 f.确认抽干
(5)用吸光光度法确定MnCO3产品纯度:通过对比样品溶液与标准溶液的吸光度测产品的纯度。准确称取Wg产品,用稀硝酸溶解,加入足量过二硫酸铵溶液作氧化剂,以硝酸银作催化剂,加热,反应方程式如下:
MnCO3+2HNO3=Mn(NO3)2+CO2↑+H2O
Mn(NO3)2+5(NH4)2S2O8+8H2O=2HMnO4+5(NH4)2SO4+5H2SO4+4HNO3
反应结束用蒸馏水定容至100mL,取10mL至比色管中,测得溶液中MnO 的吸光度为A,A=kc(k为常数,c为浓度),则MnCO3产品纯度是
的吸光度为A,A=kc(k为常数,c为浓度),则MnCO3产品纯度是____ (用含W、A、k的式子表示)。取待测液于比色管中时,移液管未润洗,测得产品纯度将____ (填“偏高”或“偏低”或“无影响”)。

已知:①碳酸锰几乎不溶于水,不溶于醇,溶于稀无机酸;受热易分解。
②Mn(Ⅳ)在酸性条件下易被还原为Mn(Ⅱ),Mn(Ⅱ)在碱性条件下易被氧化为Mn(Ⅳ)。
请回答:
(1)加入稀硫酸的作用是
(2)步骤Ⅰ:反应的离子方程式是
(3)下列操作中正确的是
| A.步骤Ⅱ将滤纸放入布氏漏斗内,用蒸馏水润湿滤纸 |
| B.步骤Ⅳ不宜烘干,可以选用减压干燥 |
| C.边搅拌边缓慢滴加饱和碳酸氢铵溶液,避免局部碱性过大使Mn(II)氧化 |
| D.步骤Ⅳ用乙醇作为洗涤剂,洗涤结束后,将固体迅速转移并进行后续操作 |

a.打开活塞K b.关闭活塞K c.加洗涤剂洗涤 d.打开抽气泵 e.关闭抽气泵 f.确认抽干
(5)用吸光光度法确定MnCO3产品纯度:通过对比样品溶液与标准溶液的吸光度测产品的纯度。准确称取Wg产品,用稀硝酸溶解,加入足量过二硫酸铵溶液作氧化剂,以硝酸银作催化剂,加热,反应方程式如下:
MnCO3+2HNO3=Mn(NO3)2+CO2↑+H2O
Mn(NO3)2+5(NH4)2S2O8+8H2O=2HMnO4+5(NH4)2SO4+5H2SO4+4HNO3
反应结束用蒸馏水定容至100mL,取10mL至比色管中,测得溶液中MnO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网