解答题-实验探究题 较难0.4 引用2 组卷145
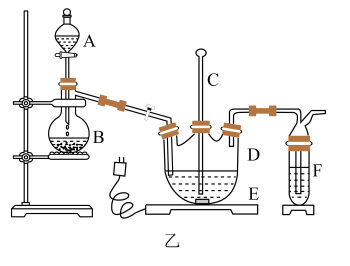
硫代硫酸钠被广泛用于纺织、造纸、化学合成等工业领域。制备硫代硫酸钠的装置如下图所示。
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
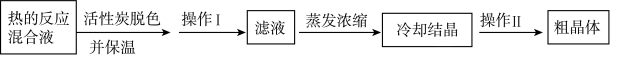
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到 晶体样品。
晶体样品。
4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:
请回答下列问题:
(1)仪器2的名称是________ 。
(2)写出生成硫代硫酸钠总反应的化学方程式________ 。
(3)补齐步骤3的实验操作________ 。
(4)用必要的文字说明为什么溶液的pH不能小于7________ 。
(5)①滴定时,应使用________ (填“酸式”或“碱式”)滴定管。
②滴定达到终点的标志是________ 。
③ 晶体的质量分数为
晶体的质量分数为________ (用含有V的代数式表示)。
④下列说法错误的是________ 。
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
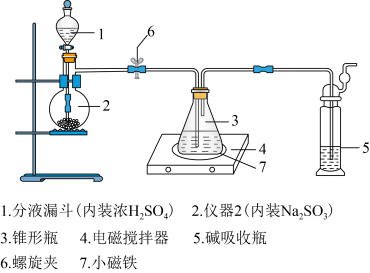
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到
4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:
请回答下列问题:
(1)仪器2的名称是
(2)写出生成硫代硫酸钠总反应的化学方程式
(3)补齐步骤3的实验操作
(4)用必要的文字说明为什么溶液的pH不能小于7
(5)①滴定时,应使用
②滴定达到终点的标志是
③
④下列说法错误的是
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
2024·辽宁大连·二模
类题推荐
过氧化尿素广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2  CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
合成过氧化尿素的流程如下:
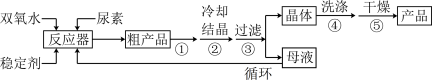
请回答下列问题:
(1)该反应的温度不能过低或过高的原因是___________
(2)步骤①宜采用的操作是____________ 。
(3)称取10.0g产品溶解在250mL蒸馏水中,移取25mL溶解后的溶液于锥形瓶中,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应).
①配制0.2000mol·L﹣1KMnO4标准溶液不需要用到的仪器有_______ (填编号)
a.托盘天平 b.电子天平 c. 滴定管 d. 烧杯 e. 锥形瓶 f. 玻璃棒 g. 胶头滴管
②用0.2000mol·L﹣1KMnO4标准溶液滴定,其中正确操作步骤的顺序为_________
a. 用移液管取用25mL待测溶液于锥形瓶中
b. 把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c. 取KMnO4标准液注入滴定管中至“0”刻度以上
d. 调节液面至“0”或“0”刻度以下,记下读数 e.把锥形瓶放在滴定管下面,用标准KMnO4液滴定至终点并记下滴定管的读数
③下列操作中的说法正确的是_________
A. KMnO4标准溶液放在酸式滴定管中
B. 滴定前,锥形瓶必须用待装液润洗
C. 滴定过程中需要用酚酞作指示剂
D. 滴定操作中,如果滴定前装有KMnO4标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏大
④为提高该滴定结果的精密度和准确度,可采取的措施是__________
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
(1)该反应的温度不能过低或过高的原因是
(2)步骤①宜采用的操作是
(3)称取10.0g产品溶解在250mL蒸馏水中,移取25mL溶解后的溶液于锥形瓶中,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应).
①配制0.2000mol·L﹣1KMnO4标准溶液不需要用到的仪器有
a.托盘天平 b.电子天平 c. 滴定管 d. 烧杯 e. 锥形瓶 f. 玻璃棒 g. 胶头滴管
②用0.2000mol·L﹣1KMnO4标准溶液滴定,其中正确操作步骤的顺序为
a. 用移液管取用25mL待测溶液于锥形瓶中
b. 把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c. 取KMnO4标准液注入滴定管中至“0”刻度以上
d. 调节液面至“0”或“0”刻度以下,记下读数 e.把锥形瓶放在滴定管下面,用标准KMnO4液滴定至终点并记下滴定管的读数
③下列操作中的说法正确的是
A. KMnO4标准溶液放在酸式滴定管中
B. 滴定前,锥形瓶必须用待装液润洗
C. 滴定过程中需要用酚酞作指示剂
D. 滴定操作中,如果滴定前装有KMnO4标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏大
④为提高该滴定结果的精密度和准确度,可采取的措施是
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网