解答题-原理综合题 适中0.65 引用4 组卷271
利用介孔限域催化温室气体 加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:
加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一,反应如下:
i.

ii.

(1)稳定单质的焓(H)为0,有关物质的焓如表所示,

___________  。
。
(2)在5.0MPa下,将 和
和 在
在 催化剂作用下进行反应i和ii.平衡时
催化剂作用下进行反应i和ii.平衡时 和CO选择性S[S(
和CO选择性S[S( 或CO)
或CO) ]及
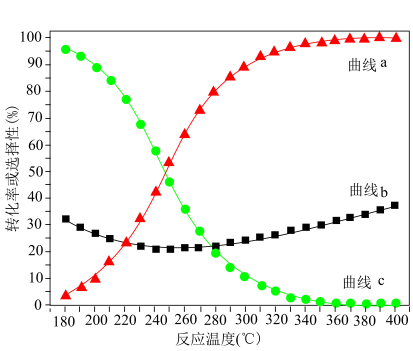
]及 的转化率a随温度的变化如图所示。
的转化率a随温度的变化如图所示。 的转化率的曲线是
的转化率的曲线是___________ (填“x”“y”或“z”)。
②250℃时,平衡体系共有 ,则
,则 的平衡转化率=
的平衡转化率=___________ ,反应i的
___________ ( 是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)。
是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)。
③p、q两点反应i的正反应速率大小:
___________  。(填“>”“=”或“<”)
。(填“>”“=”或“<”)
(3)若只发生反应ii,反应的速率方程为 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后 ,此时反应ii的速率
,此时反应ii的速率
___________  (用含k的代数式表示)。
(用含k的代数式表示)。
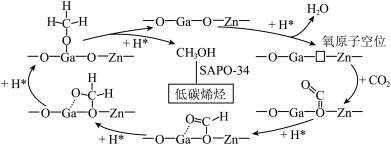
(4)我国科学者又进一步研究了在 催化剂上
催化剂上 加氢制甲醇的机理;其主反应历程如图所示
加氢制甲醇的机理;其主反应历程如图所示 。下列说法正确的是___________(填字母)。
。下列说法正确的是___________(填字母)。
i.
ii.
(1)稳定单质的焓(H)为0,有关物质的焓如表所示,
| 物质 | |||
| 焓 | -394 | -111 | -242 |
(2)在5.0MPa下,将
②250℃时,平衡体系共有
③p、q两点反应i的正反应速率大小:
(3)若只发生反应ii,反应的速率方程为
(4)我国科学者又进一步研究了在
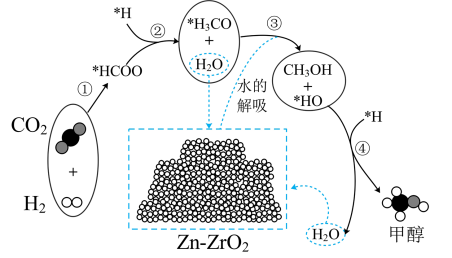
| A.二氧化碳加氢制甲醇的过程中原子利用率达100% |
| B.带*标记的物质是该反应历程中的中间产物 |
| C.第④步的反应式为 |
| D.反应历程中只有 |
2024·辽宁·三模
类题推荐
“有序介孔碳”和“纳米限域催化”的研究双双获得国家自然科学奖一等奖。利用介孔限域催化温室气体 加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一、反应如下:
加氢制甲醇,再通过甲醇制备燃料和化工原料等,是解决能源问题与实现双碳目标的主要技术之一、反应如下:
i.
ii.
iii.
(1)
_______ 。
(2)绝热条件下,将 以体积比2∶1充入恒容密闭容器中,若只发生反应ii,下列可作为反应ii达到平衡的判据是_______。
以体积比2∶1充入恒容密闭容器中,若只发生反应ii,下列可作为反应ii达到平衡的判据是_______。
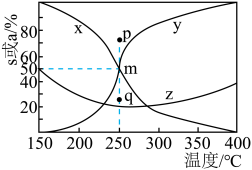
(3)将 以体积比3∶1充入恒容密闭容器中,在某介孔限域催化剂存在下发生反应i和ii。
以体积比3∶1充入恒容密闭容器中,在某介孔限域催化剂存在下发生反应i和ii。 的平衡转化率及
的平衡转化率及 的选择性(生成目标产物所消耗的反应物的物质的量与参与反应的反应物的物质的量之比)随温度变化曲线如图所示:
的选择性(生成目标产物所消耗的反应物的物质的量与参与反应的反应物的物质的量之比)随温度变化曲线如图所示:

① 加氢制甲醇,
加氢制甲醇,_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡时 的产率。结合上图阐述实际选用
的产率。结合上图阐述实际选用 反应温度的原因:
反应温度的原因:_______ 。
② 时反应i的
时反应i的
_______ 。( 是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)
是以组分体积分数代替物质的量浓度表示的平衡常数,列计算式)
(4)近日,我国学者研究发现,在单原子 催化时,反应i的历程以及中间体
催化时,反应i的历程以及中间体 与
与 物质的量之比随时间变化图如下:
物质的量之比随时间变化图如下:

第一步
第二步
第三步
下列说法正确的是_______。
(5)运用单原子 催化
催化 加氢制甲醇时,可在
加氢制甲醇时,可在 实现甲醇选择性100%,开拓了单原子催化剂应用的空白。请写出基态铜原子价层电子轨道表达式:
实现甲醇选择性100%,开拓了单原子催化剂应用的空白。请写出基态铜原子价层电子轨道表达式:_______ 。
i.
ii.
iii.
(1)
(2)绝热条件下,将
| A. | B.容器内气体密度不变 |
| C.容器内气体压强不变 | D. |

①
②
(4)近日,我国学者研究发现,在单原子

第一步
第二步
第三步
下列说法正确的是_______。
| A.任何温度下,反应i均可自发进行 |
| B.升高温度时,三步反应速率均加快 |
| C.用不同催化剂催化反应可以改变反应历程,提高平衡转化率 |
| D.反应历程中,第二步反应的活化能最高,是反应的决速步聚 |
当今中国积极推进绿色低碳发展,力争在2030年前实现碳达峰,2060年前实现碳中和。因此,研发CO2利用技术,降低空气中CO2含量成为研究热点。工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:
反应II:
(1)①一定条件下,一氧化碳加氢生成甲醇的热化学方程式为:

_______  。
。
②若反应II逆反应活化能Ea(逆)为120 ,则该反应的Ea(正)活化能为
,则该反应的Ea(正)活化能为_______  。
。
(2)①反应I在催化剂M表面进行,其中CO2生成CH3OH的历程如下图所示(*表示吸附在催化剂表面的物种,TS表示过渡态,能量的单位为eV)。

下列说法正确的是_______ 。
A.在反应过程中有极性键的断裂
B.本历程共分为5步反应进行
C.本历程的决速步骤的反应为:
D.加入催化剂M可以提高甲醇的平衡产率
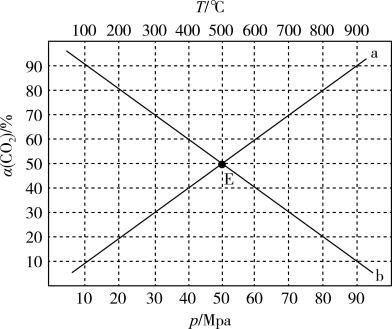
②在催化剂M表面进行反应I,当起始量 时,在不同条件下达到平衡,体系中CO2的转化率为α(CO2),在T=400℃下α(CO2)随压强变化关系和在p=60MPa下α(CO2)随温度变化关系如下图所示。其中代表在T=400℃下α(CO2)随压强变化关系的是
时,在不同条件下达到平衡,体系中CO2的转化率为α(CO2),在T=400℃下α(CO2)随压强变化关系和在p=60MPa下α(CO2)随温度变化关系如下图所示。其中代表在T=400℃下α(CO2)随压强变化关系的是_______ (填“a线”或“b线”);a、b两线的交点E对应的平衡常数_______ (填“相同”或“不同”)。当α(CO2)为80%时,反应条件可能是_______ 。
(3)温度为T℃时,在一个刚性容器中模拟工业上合成CH3OH,往容器中通入1molCO2、3molH2进行反应,反应过程中容器内的压强随着时间变化如下表所示。
(已知:CH3OH选择性= )
)
请计算反应开始至40min的平均反应速率v(CH3OH)=_______ MPa/min;此时CH3OH的选择性为80%,则反应I的压强平衡常数Kp=_______  (只列计算式,压强平衡常数:用平衡分压代替平衡浓度,分压=总压
(只列计算式,压强平衡常数:用平衡分压代替平衡浓度,分压=总压 气体物质的量分数)。
气体物质的量分数)。
反应I:
反应II:
(1)①一定条件下,一氧化碳加氢生成甲醇的热化学方程式为:
②若反应II逆反应活化能Ea(逆)为120
(2)①反应I在催化剂M表面进行,其中CO2生成CH3OH的历程如下图所示(*表示吸附在催化剂表面的物种,TS表示过渡态,能量的单位为eV)。

下列说法正确的是
A.在反应过程中有极性键的断裂
B.本历程共分为5步反应进行
C.本历程的决速步骤的反应为:
D.加入催化剂M可以提高甲醇的平衡产率
②在催化剂M表面进行反应I,当起始量

(3)温度为T℃时,在一个刚性容器中模拟工业上合成CH3OH,往容器中通入1molCO2、3molH2进行反应,反应过程中容器内的压强随着时间变化如下表所示。
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 压强/MPa | 120 | 105 | 95 | 90 | 88 | 88 |
(已知:CH3OH选择性=
请计算反应开始至40min的平均反应速率v(CH3OH)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网