解答题-实验探究题 较难0.4 引用1 组卷52
硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: 的制备
的制备
(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是_____ 。
(2)步骤②在常温下进行,需要加入的试剂有稀 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为_____ 。
Ⅱ.晶体的制备
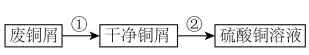
将上述制备的 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
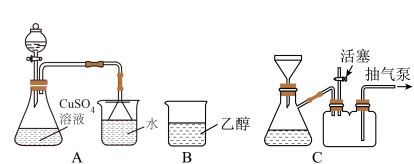
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。_____ 。
(4)抽滤时,抽气泵处于工作状态,活塞需_____ (填“打开”或“关闭”),作用是_____ 。
(5)使用下列试剂可代替乙醇来促进 晶体析出的有
晶体析出的有_____ 。(填标号)
a. b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液
(6)晶体采用冷风吹干而不用加热烘干的原因是_____ 。
Ⅲ.废液回收
减压过滤后的废液中含有 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。
(7) 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为_____ 。
(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是
(2)步骤②在常温下进行,需要加入的试剂有稀
Ⅱ.晶体的制备
将上述制备的
(4)抽滤时,抽气泵处于工作状态,活塞需
(5)使用下列试剂可代替乙醇来促进
a.
(6)晶体采用冷风吹干而不用加热烘干的原因是
Ⅲ.废液回收
减压过滤后的废液中含有
(7)
2024·内蒙古包头·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网