解答题-原理综合题 较难0.4 引用1 组卷135
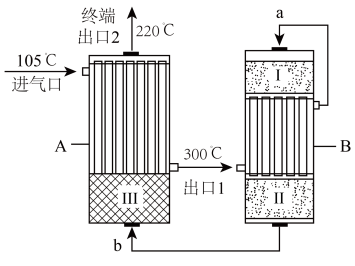
合成氨工业对国民经济和社会发展具有重要的意义,工业合成氮的流程如下:
(1)步骤①中需对原料气进行净化,目的是___________ 。
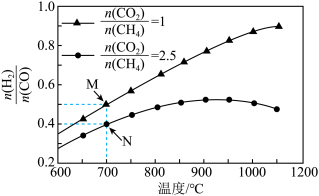
(2)下列说法正确的是___________。
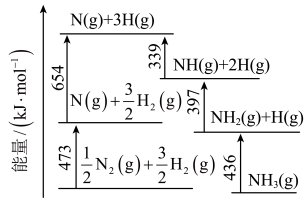
(3) 过渡金属复合催化剂可用于催化合成氨,已知
过渡金属复合催化剂可用于催化合成氨,已知 被吸附发生反应
被吸附发生反应 ,用一个化学方程式表示
,用一个化学方程式表示 被吸附发生的反应
被吸附发生的反应___________ 。
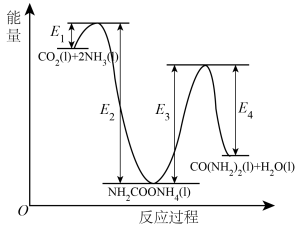
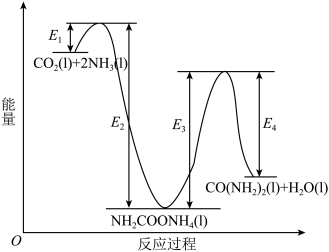
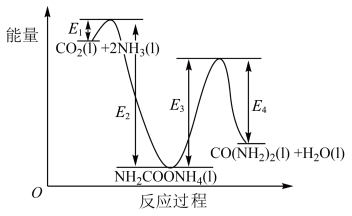
(4)早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:
Ⅰ.
Ⅱ.
①
___________  (用图中字母表示)。
(用图中字母表示)。___________ (填“Ⅰ”或“Ⅱ”)。
(5)实验室利用以下装置模拟了硝酸盐还原为氨的反应,总反应为: 。
。___________ 。
②每产生11.2L (标准状况),B区溶液质量减少
(标准状况),B区溶液质量减少___________ 克。
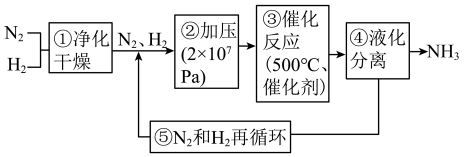
(1)步骤①中需对原料气进行净化,目的是
(2)下列说法正确的是___________。
| A.步骤①除原料气中CO反应: |
| B.步骤②“加压”可以加快反应速率,但压强过高,氨的产率会降低 |
| C.步骤③500℃左右比室温更有利于合成氨的反应,提高氨气的产率 |
| D.步骤④⑤有利于提高原料的利用率,能节约生产成本 |
(3)
(4)早在二十世纪初,工业上以
Ⅰ.
Ⅱ.
①
(5)实验室利用以下装置模拟了硝酸盐还原为氨的反应,总反应为:
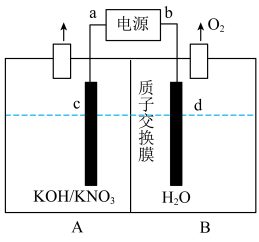
②每产生11.2L
2024·天津·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网