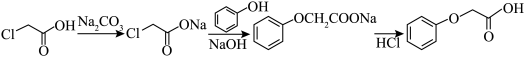
解答题-实验探究题 适中0.65 引用1 组卷292
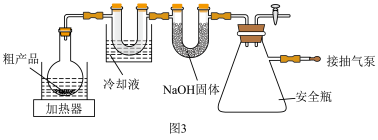
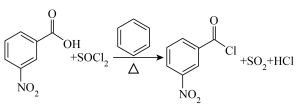
3-硝基苯甲酰氯( )能用于制染料和有机合成,一种实验室制备原理如图所示:
)能用于制染料和有机合成,一种实验室制备原理如图所示: 、
、 的沸点分别为80℃、78.6℃;②
的沸点分别为80℃、78.6℃;② 和3-硝基苯甲酰氯均易与水反应。
和3-硝基苯甲酰氯均易与水反应。
实验步骤:
ⅰ.在三颈烧瓶中加入3-硝基苯甲酸26.72g( )、50 mL
)、50 mL (0.42 mol)和200 mL无水苯;
(0.42 mol)和200 mL无水苯;
ⅱ.加热至80~85℃搅拌回流5h;
ⅲ.反应完毕,减压回收 和
和 ,冷却,析出黄色晶体;
,冷却,析出黄色晶体;
ⅳ.抽滤、洗涤、干燥、提纯,得22.26g产品。
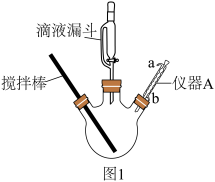
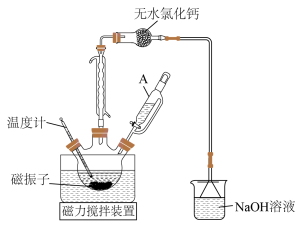
(1)三颈烧瓶洗涤干净后,组装仪器前必须进行的操作是____________ ;相对普通分液漏斗,仪器A的主要优点是____________ 。
(2)本实验中,需要加入一定量的苯,其目的是____________ 。
(3)无水氯化钙______ (填“能”或“不能”)用碱石灰代替,其原因是____________ 。
(4)磁振子起到的两个作用是____________ 。
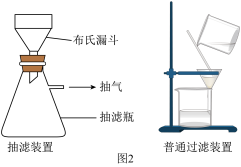
(5)抽滤装置如图所示,抽滤的先后操作顺序为a→c→b→d→g→______ (填字母)。
e.取下抽滤瓶上的橡皮管f.关闭抽气泵g.洗涤h.确认抽干
(6)本实验3-硝基苯甲酰氯的产率为______ %。
实验步骤:
ⅰ.在三颈烧瓶中加入3-硝基苯甲酸26.72g(
ⅱ.加热至80~85℃搅拌回流5h;
ⅲ.反应完毕,减压回收
ⅳ.抽滤、洗涤、干燥、提纯,得22.26g产品。
(1)三颈烧瓶洗涤干净后,组装仪器前必须进行的操作是
(2)本实验中,需要加入一定量的苯,其目的是
(3)无水氯化钙
(4)磁振子起到的两个作用是
(5)抽滤装置如图所示,抽滤的先后操作顺序为a→c→b→d→g→
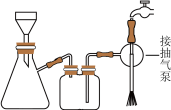
e.取下抽滤瓶上的橡皮管f.关闭抽气泵g.洗涤h.确认抽干
(6)本实验3-硝基苯甲酰氯的产率为
2024·安徽·模拟预测
类题推荐
乙酰苯胺可用作止痛剂、防腐剂等。实验室通过如下方法制备、提纯乙酰苯胺。已知:
I.粗乙酰苯胺的制备
制备原理: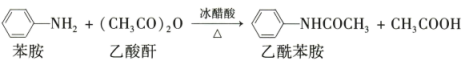 。
。
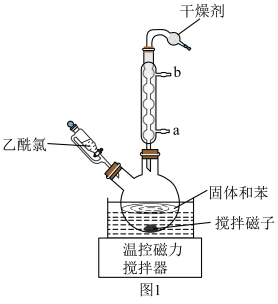
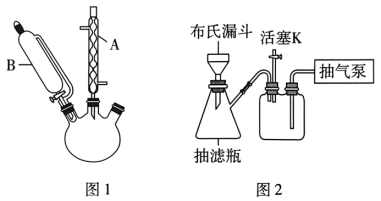
实验装置如图1所示(夹持装置略)。
实验步骤:将 (
( )乙酸酐、
)乙酸酐、 (
( )冰醋酸加入三颈烧瓶中,在仪器B中加入
)冰醋酸加入三颈烧瓶中,在仪器B中加入 (
( )苯胺,逐滴滴加到三颈烧瓶中,边滴边搅拌,滴加完毕后小火加热
)苯胺,逐滴滴加到三颈烧瓶中,边滴边搅拌,滴加完毕后小火加热 。在搅拌下,趁热把反应混合物慢慢倒入
。在搅拌下,趁热把反应混合物慢慢倒入 冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
冷水中,析出固体。将混合物抽滤得到乙酰苯胺粗品。
II.乙酰苯胺的提纯
①将粗乙酰苯胺晶体加入盛有 热水的烧杯中,加热至沸,使之溶解。
热水的烧杯中,加热至沸,使之溶解。
②稍冷却后,加入适量粉末状活性炭,充分搅拌后趁热进行抽滤。
③将滤液转移到干净烧杯中,冷却、抽滤,用少量冷水洗涤、抽滤。
④将产物放在干净的表面皿中晾干、称重,质量为 。
。
回答下列问题:
(1)仪器A的名称是___________ ,其作用为______________________ 。
(2)本实验所用三颈烧瓶的适宜规格为___________  (填标号)。
(填标号)。
A.100 B.250 C.500
(3)制备乙酰苯胺粗品过程中,将反应混合物倒入冷水中的目的是_________________ 。
(4)提纯过程中步骤②中加入活性炭的目的是________________ 。
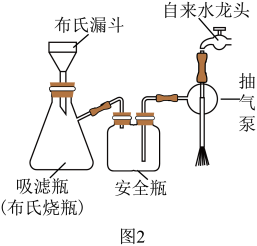
(5)用图2所示装置进行提纯过程中步骤③中的抽滤和洗涤。请按正确的操作顺序补充完整(只进行一次洗涤操作):打开抽气泵→转移混合物至布氏漏斗→关闭活塞K→确认抽干→打开活塞K→___________ →___________ →确认抽干→打开活塞K→关闭抽气泵。本实验多次采用抽滤操作,其优点是________ 。
(6)本实验中乙酰苯胺的产率为___________ %(保留三位有效数字)。
| 苯胺 | 乙酸酐 | 冰醋酸 | 乙酰苯胺 |
| 沸点为 | 沸点为 | 沸点为 | 无色晶体,沸点为 |
制备原理:
 。
。实验装置如图1所示(夹持装置略)。

实验步骤:将
II.乙酰苯胺的提纯
①将粗乙酰苯胺晶体加入盛有
②稍冷却后,加入适量粉末状活性炭,充分搅拌后趁热进行抽滤。
③将滤液转移到干净烧杯中,冷却、抽滤,用少量冷水洗涤、抽滤。
④将产物放在干净的表面皿中晾干、称重,质量为
回答下列问题:
(1)仪器A的名称是
(2)本实验所用三颈烧瓶的适宜规格为
A.100 B.250 C.500
(3)制备乙酰苯胺粗品过程中,将反应混合物倒入冷水中的目的是
(4)提纯过程中步骤②中加入活性炭的目的是
(5)用图2所示装置进行提纯过程中步骤③中的抽滤和洗涤。请按正确的操作顺序补充完整(只进行一次洗涤操作):打开抽气泵→转移混合物至布氏漏斗→关闭活塞K→确认抽干→打开活塞K→
(6)本实验中乙酰苯胺的产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网