解答题-原理综合题 较难0.4 引用2 组卷93
二氧化碳和氢气合成甲醇发生反应的热化学方程式为:
主反应:①

副反应:②

回答下列问题:
(1)二氧化碳加氢制备甲醇若选用水作为氢源,反应的热化学方程式为:
③

已知反应:④

则
___________  。从反应自发性角度考虑,工业上应选择
。从反应自发性角度考虑,工业上应选择___________ (填“反应①”或“反应③”)合成甲醇。
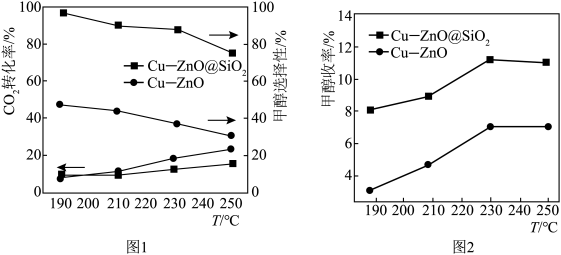
(2)在一定条件下,二氧化碳和氢气合成甲醇,温度对反应结果的影响如图所示。已知,在图中所示温度范围内,温度升高更有利于CO的生成。图1中曲线分别为 的转化率和甲醇的选择性(甲醇的选择性
的转化率和甲醇的选择性(甲醇的选择性 ,下同),则代表
,下同),则代表 的转化率的曲线是
的转化率的曲线是___________ (填“I”或“II”)。图2中曲线为甲醇的产率变化,当温度高于240℃时,甲醇的产率随温度升高而降低,可能原因是___________ 。 的转化率为25%,CO为amol,
的转化率为25%,CO为amol, 为bmol,甲醇的选择性为c,
为bmol,甲醇的选择性为c, 的物质的量为
的物质的量为___________ mol(用含a,b、c的代数式表示,下同),反应②的平衡常数为___________ 。
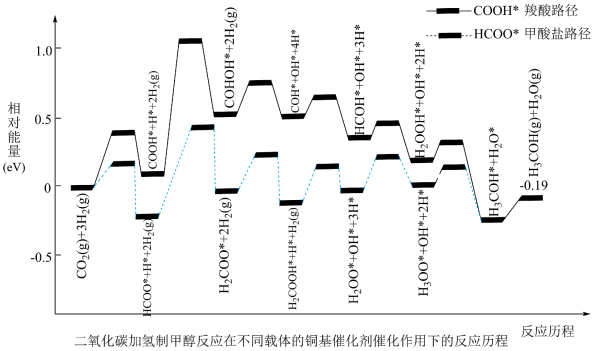
(4)计算机模拟在某种催化剂作用下二氧化碳和氢气合成甲醇的两种反应路径如图所示,RWGS路径由 开始,
开始, 路径由
路径由 开始,两种路径部分相同。图中吸附在催化剂表面上的物种用*标注,TS代表过渡态。
开始,两种路径部分相同。图中吸附在催化剂表面上的物种用*标注,TS代表过渡态。___________ (填“RWGS路径”或“HCOO*路径”),该路径中决定反应速率快慢的步骤为___________ 。
主反应:①
副反应:②
回答下列问题:
(1)二氧化碳加氢制备甲醇若选用水作为氢源,反应的热化学方程式为:
③
已知反应:④
则
(2)在一定条件下,二氧化碳和氢气合成甲醇,温度对反应结果的影响如图所示。已知,在图中所示温度范围内,温度升高更有利于CO的生成。图1中曲线分别为
(4)计算机模拟在某种催化剂作用下二氧化碳和氢气合成甲醇的两种反应路径如图所示,RWGS路径由

2024·河南·模拟预测
类题推荐
研发二氧化碳的碳捕集和碳利用技术及合成氨是科学研究热点问题,回答下列问题:
(1)常温常压下,一些常见物质的燃烧热如表所示:
已知:

则

_____  ,该反应在
,该反应在______ (填“高温”“低温”或“任意温度”)下能自发进行。
(2) 催化加氢制取甲醇,反应如下:
催化加氢制取甲醇,反应如下:
主反应:

副反应:

在一定条件下,向某 恒容密闭容器中充入
恒容密闭容器中充入 和
和 发生反应,起始总压强为
发生反应,起始总压强为 。实验测得
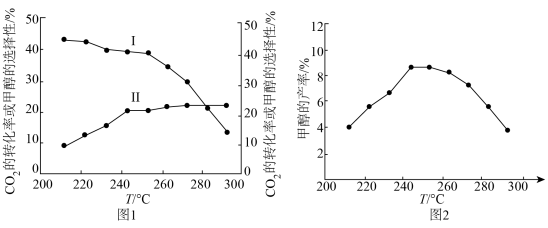
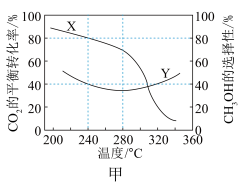
。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图所示:
的选择性随温度变化如图所示:
已知: 的选择性
的选择性 %。
%。
图中表示平衡时 的选择性的曲线为
的选择性的曲线为_____ (填“X”或“Y”),温度高于280℃时,曲线Y随温度升高而升高的原因是________ 。240℃时,反应 容器内达到平衡状态,副反应的
容器内达到平衡状态,副反应的 ,初始充入
,初始充入 的物质的量
的物质的量
_____ mol。
(3)工业利用 、
、 催化合成氨实现了人类“向空气中要面包”的梦想。原料气(含
催化合成氨实现了人类“向空气中要面包”的梦想。原料气(含 、
、 、CO)中的CO能被催化剂吸附,需经过铜氨液处理除去,反应为:
、CO)中的CO能被催化剂吸附,需经过铜氨液处理除去,反应为:
 。
。
①除去原料气中CO的理由是___________ 。
②研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注。该反应历程中最大活化能对应步骤的化学方程式为______ 。
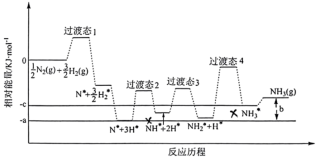
③铁催化合成氨时 与
与 需吸附在催化剂表面活性位点进行反应,由合成氨反应的速率方程
需吸附在催化剂表面活性位点进行反应,由合成氨反应的速率方程 (k为速率常数)可知,
(k为速率常数)可知, 越大,反应速率越小。原因是
越大,反应速率越小。原因是_____ 。
(1)常温常压下,一些常见物质的燃烧热如表所示:
| 名称 | 氢气 | 甲烷 | 一氧化碳 | 甲醇 |
则
(2)
主反应:
副反应:
在一定条件下,向某

已知:
图中表示平衡时
(3)工业利用
①除去原料气中CO的理由是
②研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注。该反应历程中最大活化能对应步骤的化学方程式为

③铁催化合成氨时
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网