单选题 适中0.65 引用1 组卷99
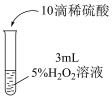
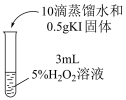
实验小组探究双氧水与KI的反应,实验方案如下表。
下列说法不正确 的是
| 序号 | ① | ② | ③ |
| 实验装置及操作 |
|
|
|
| 实验现象 | 溶液无明显变化 | 溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色 | 溶液立即变为棕黄色,产生少量无色气体;溶液颜色逐渐加深,温度无明显变化;最终有紫黑色沉淀析出 |
下列说法
| A.KI对H2O2的分解有催化作用 |
| B.①为了排除稀硫酸对实验的干扰 |
| C.对比②和③,②中的现象可能是因为H2O2分解的速率大于H2O2氧化KI的速率 |
| D.实验②③中的温度差异说明,H2O2氧化KI的反应放热 |
23-24高二下·北京海淀·阶段练习
类题推荐
某小组同学探究SO2与Fe3+盐溶液的反应,进行了如下实验:已知:Fe3++HSO ⇌Fe(HSO3)2+(红棕色)
⇌Fe(HSO3)2+(红棕色)
结合上述实验,下列说法不正确的是
| 实验 | ① | ② | ③ |
| 操作 | 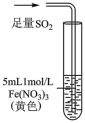 | 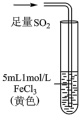 | 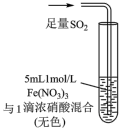 |
| 现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5h后溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5h后溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5h后溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
| A.产生红棕色物质的反应速率快于SO2与Fe3+氧化还原反应的速率 |
| B.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,可能是因为加入了浓硝酸抑制了Fe3+的水解 |
| C.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响 |
| D.5h后③比①黄色更深能证明是NO |
化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______ 。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______ 。
②实验现象“最初反应较慢,随后加快”的原因可能是______ 。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是______ 。
②NO2与H2O反应生成HNO2和______ 。
③对生成HNO2后反应变快的原因进行实验探究。
a.III中加入的固体为______ 。
b.IV中“放置一段时间”的目的是______ 。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是______ 。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
| 实验装置 | 实验现象 |
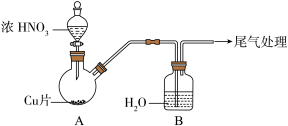 | A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
②实验现象“最初反应较慢,随后加快”的原因可能是
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是
②NO2与H2O反应生成HNO2和
③对生成HNO2后反应变快的原因进行实验探究。
| 序号 | 实验操作 | 实验现象 |
| III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
| IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
b.IV中“放置一段时间”的目的是
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是
某小组同学探究SO2与Fe3+盐溶液的反应,进行了如下实验:
已知:Fe3++HSO
 Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)
结合上述实验,下列说法不正确 的是
已知:Fe3++HSO
| 实验 | ① | ② | ③ |
| 操作 | 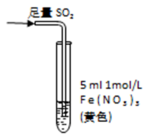 |  |  |
| 现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h后,溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h后,溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5 h后,溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
| A.产生红棕色物质的反应速率慢于SO2与Fe3+氧化还原反应的速率 |
| B.①与②对照,说明阴离子种类对SO2与Fe3+氧化还原反应的速率有影响 |
| C.Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,可能是浓硝酸的H+抑制了Fe3水解 |
| D.5 h后③比①黄色更深不能证明是NO |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网