解答题-实验探究题 较易0.85 引用1 组卷73
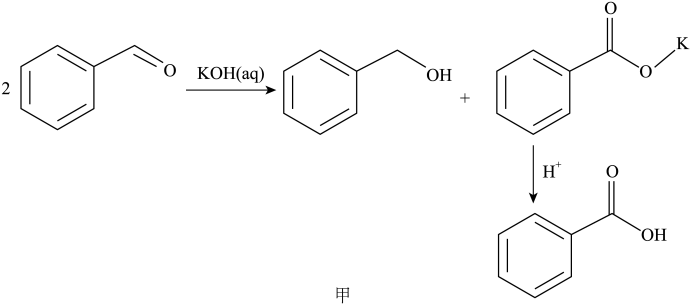
某小组设计实验制备苯甲酸:
【原理】
 苯甲醛(新蒸),
苯甲醛(新蒸), 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。
【资料】
乙醚的密度为 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
【步骤】
①在锥形瓶中将 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。
②向反应混合物中逐滴加入足量的水(约 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
③过滤后蒸馏,收集204~206℃的馏分。
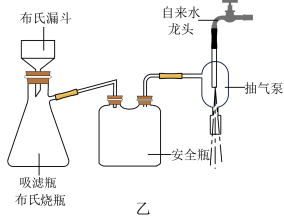
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸 。
。
(1)苯甲醇中最多有___________ 个原子共平面。
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为___________ (填标号);分离乙醚相的具体操作是___________ 。
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和 溶液、
溶液、 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是___________ 、___________ 。
(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?___________ (填“最恰当”或“不恰当”),理由是___________ 。
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有___________ 、___________ (答两点)。
(6)本实验的苯甲酸产率约为___________(填标号)。
【原理】
【资料】
乙醚的密度为
【步骤】
①在锥形瓶中将
②向反应混合物中逐滴加入足量的水(约
③过滤后蒸馏,收集204~206℃的馏分。
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸
(1)苯甲醇中最多有
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和
(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有
(6)本实验的苯甲酸产率约为___________(填标号)。
| A. | B. | C. | D. |
23-24高三下·河北沧州·期中
类题推荐
苯甲醇与苯甲酸都是常见化工原料,在化工生产中有广泛应用。工业上常在碱性条件下由苯甲醛来制备。某实验室模拟其生产过程,实验原理、实验方法及步骤如下:
实验原理: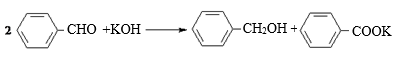
有关资料:
苯甲醛空气中极易被氧化,生成白色苯甲酸。
实验步骤及方法如下:
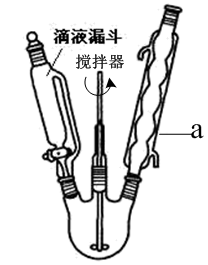
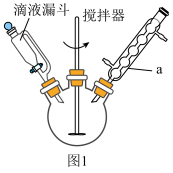
I.向盛有足量KOH溶液的反应器中,分批加入新蒸过的13.5 mL(14.0 g)苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上;反应装置如图:
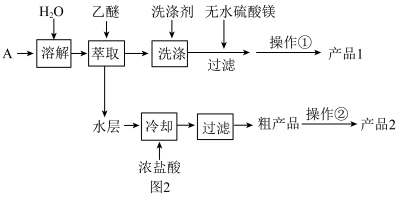
II.步骤I所得产物后续处理如下:
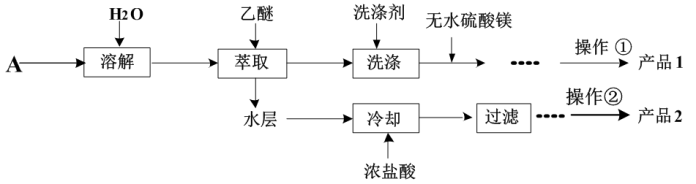
(1)仪器a的名称为_______ 。
(2)步骤1中苯甲醛需要分批加入且适时冷却,其原因是_______ 。
(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后_______ (填“上”或“下”)层液体加入无水MgSO4,其作用为_______ , 操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为_______ 。
(4)水层中加入浓盐酸发生反应的离子方程式为_______ 。
(5)操作②包含溶解、蒸发浓缩、结晶、晾干, 下列仪器中在该操作中不需要用到的有_______ (填序号)。
A.分液漏斗 B.蒸发皿 C.研钵 D.玻璃棒
(6)①若产品2产率比预期值稍高,可能原因是_______ 。
A.过滤后未干燥完全 B.产品中混有其他杂质
C.过滤时滤液浑浊 D.部分苯甲醛被直接氧化为苯甲酸
②产品2经干燥后称量,质量为6.1 g,计算其产率为_______ (保留3位有效数字,写出计算过程)。
实验原理:

有关资料:
| 名称 | 相对分子质量 | 熔点 (℃) | 沸点 (℃) | 溶解性 | ||
| 水 | 醇 | 醚 | ||||
| 苯甲醛 | 106 | -26 | 179.62 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶 | 易溶 | 易溶 |
| 苯甲醇 | 108 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | -116.3 | 34.6 | 微溶 | 易溶 | —— |
实验步骤及方法如下:
I.向盛有足量KOH溶液的反应器中,分批加入新蒸过的13.5 mL(14.0 g)苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上;反应装置如图:

II.步骤I所得产物后续处理如下:

(1)仪器a的名称为
(2)步骤1中苯甲醛需要分批加入且适时冷却,其原因是
(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后
(4)水层中加入浓盐酸发生反应的离子方程式为
(5)操作②包含溶解、蒸发浓缩、结晶、晾干, 下列仪器中在该操作中不需要用到的有
A.分液漏斗 B.蒸发皿 C.研钵 D.玻璃棒
(6)①若产品2产率比预期值稍高,可能原因是
A.过滤后未干燥完全 B.产品中混有其他杂质
C.过滤时滤液浑浊 D.部分苯甲醛被直接氧化为苯甲酸
②产品2经干燥后称量,质量为6.1 g,计算其产率为
苯甲醇与苯甲酸都是常见化工原料,在化工生产中有广泛应用。工业上常在碱性条件下由苯甲醛来制备。某实验室模拟其生产过程,实验原理、实验方法及步骤如下:
实验原理:
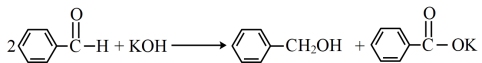
有关资料:
苯甲醛在空气中极易被氧化,生成白色苯甲酸。
实验步骤及方法如下:
I.向盛有足量 溶液的反应器中分批加入新蒸过的
溶液的反应器中分批加入新蒸过的 苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上。
苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上。
反应装置如图1:
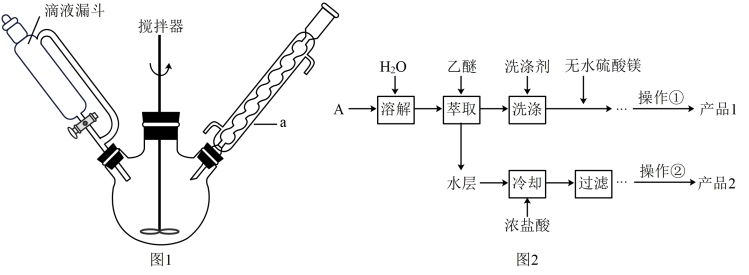
II.步骤I所得产物后续处理如图2:
(1)仪器a的名称为_______ 。
(2)步骤I中苯甲醛需要分批加入且适时冷却,其原因是_______ 。
(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后_____ (填“上”或“下”)层液体加入无水 ,其作用为
,其作用为_____ ,操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为______ 。
(4)水层中加入浓盐酸发生反应的离子方程式为_______ 。
(5)操作②包含溶解、蒸发浓缩、结晶、晾干,下列仪器中在该操作中不需要 用到的有____(填序号)。
(6)①若产品2产率比预期值稍高,可能原因是_______ 。
A.操作②未彻底晾干 B.产品中混有其他杂质
C.过滤时滤液浑浊 D.部分苯甲醛被直接氧化为苯甲酸
②产品2经干燥后称量,质量为6.1g,计算其产率为_______ (保留3位有效数字,写出计算过程)。
实验原理:

有关资料:
| 名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 溶解性 | ||
| 水 | 醇 | 醚 | ||||
| 苯甲醛 | 106 | 179.62 | 微溶 | 易溶 | 易溶 | |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶 | 易溶 | 易溶 |
| 苯甲醇 | 108 | 205.7 | 微溶 | 易溶 | 易溶 | |
| 乙醚 | 74 | 34.6 | 微溶 | 易溶 | —— | |
实验步骤及方法如下:
I.向盛有足量
反应装置如图1:

II.步骤I所得产物后续处理如图2:
(1)仪器a的名称为
(2)步骤I中苯甲醛需要分批加入且适时冷却,其原因是
(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后
(4)水层中加入浓盐酸发生反应的离子方程式为
(5)操作②包含溶解、蒸发浓缩、结晶、晾干,下列仪器中在该操作中
| A.分液漏斗 | B.蒸发皿 | C.研钵 | D.玻璃棒 |
A.操作②未彻底晾干 B.产品中混有其他杂质
C.过滤时滤液浑浊 D.部分苯甲醛被直接氧化为苯甲酸
②产品2经干燥后称量,质量为6.1g,计算其产率为
苯甲醇与苯甲酸都是常见的化工原料,工业上常在碱性条件下由苯甲醛制备苯甲醇与苯甲酸。某实验室模拟其生产过程,实验原理、实验方法及步骤如下:
实验原理: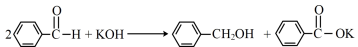 (该反应放热)
(该反应放热)
查阅资料:苯甲醛在空气中极易被氧化,生成白色苯甲酸。
实验方法及步骤如下:
I.向盛有足量KOH溶液的反应器中分批加入新蒸过的10.2mL(10.6g)苯甲醛,持续搅拌至混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上。反应装置如图1所示。
Ⅱ.步骤I所得产物后续处理如图2所示。
回答下列问题。
(1)仪器a的名称为___________ 。
(2)步骤I中苯甲醛需要分批加入且适时冷却的原因是___________ 。
(3)产品1在核磁共振氢谱图中有___________ 组峰。
(4)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。“萃取”时,应取分液后___________ (填“上”或“下”)层液体并加入无水MgSO4,操作①的名称为___________ 。
(5)产品2经干燥后称量,质量为5.6g,计算其产率为___________ (精确到0.1%)。
实验原理:
 (该反应放热)
(该反应放热)查阅资料:苯甲醛在空气中极易被氧化,生成白色苯甲酸。
| 名称 | 相对分子质量 | 密度 | 熔点(℃) | 沸点(℃) | 溶解性 | ||
| 水 | 醇 | 醚 | |||||
| 苯甲醛 | 106 | 1.04g/cm³ | -26 | 179.62 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 1.26g/cm³ | 122.13 | 249 | 微溶 | 易溶 | 易溶 |
| 苯甲醇 | 108 | 1.04g/cm³ | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | 0.714g/cm³ | -116.3 | 34.6 | 微溶 | 易溶 | ___________ |
I.向盛有足量KOH溶液的反应器中分批加入新蒸过的10.2mL(10.6g)苯甲醛,持续搅拌至混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上。反应装置如图1所示。
Ⅱ.步骤I所得产物后续处理如图2所示。


回答下列问题。
(1)仪器a的名称为
(2)步骤I中苯甲醛需要分批加入且适时冷却的原因是
(3)产品1在核磁共振氢谱图中有
(4)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。“萃取”时,应取分液后
(5)产品2经干燥后称量,质量为5.6g,计算其产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


