解答题-实验探究题 较难0.4 引用2 组卷215
氮化硅( )具有高强度、低密度、耐高温的特性,有“结构陶瓷之王”的美称。科研人员采用氨解法制备氮化硅。
)具有高强度、低密度、耐高温的特性,有“结构陶瓷之王”的美称。科研人员采用氨解法制备氮化硅。
Ⅰ.制备流程:
已知:① 在潮湿的空气中极易水解;
在潮湿的空气中极易水解; 遇水生成二氧化硅和氨,不稳定易被氧化;
遇水生成二氧化硅和氨,不稳定易被氧化;
② 沸点-33.5℃,熔点.-77.75℃,800℃以上会分解;正己烷(作反应溶剂)沸点69℃,熔点-95℃。
沸点-33.5℃,熔点.-77.75℃,800℃以上会分解;正己烷(作反应溶剂)沸点69℃,熔点-95℃。
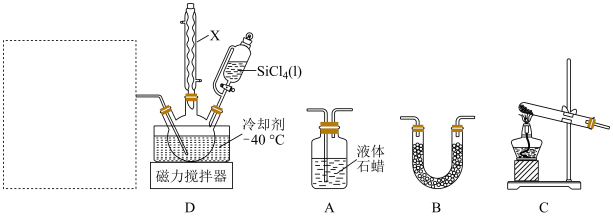
Ⅱ.实验装置如图:
氮化硅前驱体的制备:______ 。
(2)完善虚线框内的装置顺序______ 。
______→______→______→D
(3)写出流程(Ⅱ)中生成: 的化学方程式
的化学方程式______ 。
(4)下列说法正确的是______。
(5)经测定,氨解法制备所得的;Si3N4晶体中含有碳杂质,请分析原因______ 。
(6)电位滴定法测定 含量:称取1.000g试样,加入40mL水,在恒温加热磁力搅拌器上溶解,过滤、洗涤;再向其中加入22mL乙醇、4滴硝酸,用0.0010mol/L硝酸银标准溶液滴定,当滴定曲线出现等当点时,即为滴定终点,消耗硝酸银溶液的体积为amL。另取40mL水重复上述实验,消耗硝酸银溶液体积为bmL,请列出样品中杂质
含量:称取1.000g试样,加入40mL水,在恒温加热磁力搅拌器上溶解,过滤、洗涤;再向其中加入22mL乙醇、4滴硝酸,用0.0010mol/L硝酸银标准溶液滴定,当滴定曲线出现等当点时,即为滴定终点,消耗硝酸银溶液的体积为amL。另取40mL水重复上述实验,消耗硝酸银溶液体积为bmL,请列出样品中杂质 含量的表达式
含量的表达式______ mg/g。
Ⅰ.制备流程:
已知:①
②
Ⅱ.实验装置如图:
氮化硅前驱体的制备:
(2)完善虚线框内的装置顺序
______→______→______→D
(3)写出流程(Ⅱ)中生成:
(4)下列说法正确的是______。
| A.仪器X的主要作用为冷凝回流 |
| B.已知 |
| C.装置D可选用冰水混合物做冷却剂 |
| D.F中所装的液体为浓硫酸,D装置中有一处需要改进 |
(5)经测定,氨解法制备所得的;Si3N4晶体中含有碳杂质,请分析原因
(6)电位滴定法测定
2024·浙江·二模
类题推荐
乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如图:

已知:①醋酸酐遇水生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水。
③主要试剂和产品的物理常数(见表):
实验过程:在100mL锥形瓶中加入水杨酸6.9g及醋酸酐10mL,充分摇动使固体完全溶解。缓慢滴加0.5mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作。
①在不断搅拌下将反应后的混合物倒入100mL冷水中,析出固体,过滤。
②所得结晶粗品加入50mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体4.9g。
回答下列问题:
(1)该合成反应中应采用___ 加热。(填标号)
A.煤气灯 B.酒精灯 C.热水浴 D.电炉
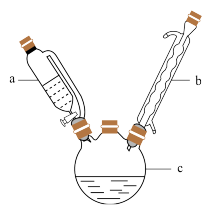
(2)若实验在如图装置中进行:仪器a的名称是___ ,仪器b的名称是___ 。
(3)①中需使用冷水,目的是___ 。
(4)②中饱和碳酸氢钠的作用是___ ,以便过滤除去难溶杂质。
(5)④采用的纯化方法为___ 。
(6)本实验的产率是___ 。(计算结果保留3位有效数字)
(7)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
①称取阿司匹林样品ag;
②将样品研碎,溶于V1mLxmol/LNaOH溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加几滴甲基橙,用浓度为ymol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2mL。
Ⅰ.写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:___ 。
Ⅱ.阿司匹林药片中乙酰水杨酸质量分数的表达式为:___ 。

| 名称 | 相对分子质量 | 熔点或沸点(℃) | 相对密度/(g·cm-3) |
| 水杨酸 | 138 | 158(熔点) | 1.44 |
| 醋酸酐 | 102 | 139.4(沸点) | 1.10 |
| 乙酰水杨酸 | 180 | 135(熔点) | 1.35 |
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水。
③主要试剂和产品的物理常数(见表):
实验过程:在100mL锥形瓶中加入水杨酸6.9g及醋酸酐10mL,充分摇动使固体完全溶解。缓慢滴加0.5mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作。
①在不断搅拌下将反应后的混合物倒入100mL冷水中,析出固体,过滤。
②所得结晶粗品加入50mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体4.9g。
回答下列问题:
(1)该合成反应中应采用
A.煤气灯 B.酒精灯 C.热水浴 D.电炉
(2)若实验在如图装置中进行:仪器a的名称是

(3)①中需使用冷水,目的是
(4)②中饱和碳酸氢钠的作用是
(5)④采用的纯化方法为
(6)本实验的产率是
(7)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
①称取阿司匹林样品ag;
②将样品研碎,溶于V1mLxmol/LNaOH溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加几滴甲基橙,用浓度为ymol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2mL。
Ⅰ.写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:
Ⅱ.阿司匹林药片中乙酰水杨酸质量分数的表达式为:
二氧化硫脲[ ](
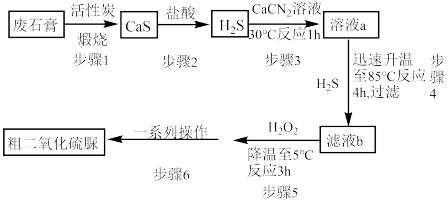
]( )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
]( ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:



②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:



该产品中二氧化硫脲的质量分数为____________ 。

①滤液b主要成份为硫脲[
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
| A.装置B中装的X溶液为饱和 |
| B.装置E中的 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
涉及到的反应有:
②另取0.1000g产品,加入50.00mL 0.1000
涉及到的反应有:
该产品中二氧化硫脲的质量分数为
已知在中性条件下(pH=5~8),甲苯可以被高锰酸钾中性溶液氧化成苯甲酸钾,实验室用下列方法制备苯甲酸。
主要实验装置和流程如图:
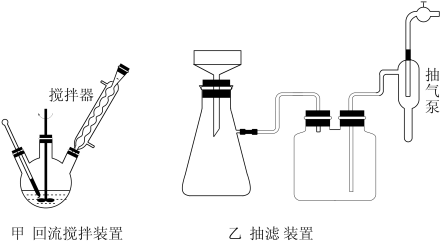
反应试剂、产物的物理性质如表:
实验方法:一定量的甲苯和KMnO4溶液置于图甲装置中,在90℃时,反应一段时间,再停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯。
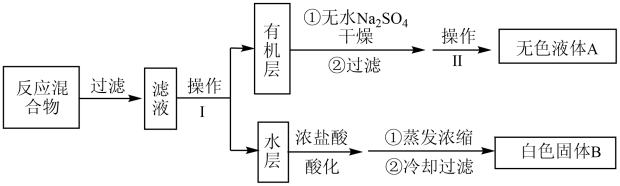
(1)已知反应混合物过滤后滤渣中含有 ,则甲中化学反应方程式为
,则甲中化学反应方程式为_______ 。
(2)无色液体A的结构简式为_______ 。操作Ⅱ为_______ 。
(3)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是_______ 。
(4)下列关于仪器的组装或使用正确的是_______(填标号)。
(5)除去残留在苯甲酸中的甲苯应先加入_______ ,分液,水层再加入_______ ,然后抽滤,干燥即可得到苯甲酸。
(6)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,用0.1mol/L的KOH标准溶液进行滴定,中和滴定时应该使用的指示剂为_______ (A.甲基橙;B.石蕊;C.酚酞),当滴加最后一滴标准KOH溶液,溶液由_______ 表示达到滴定终点,测得消耗KOH溶液的体积为24.00mL,则产品中苯甲酸的质量分数为_______ 。
主要实验装置和流程如图:

反应试剂、产物的物理性质如表:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/ | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |

(1)已知反应混合物过滤后滤渣中含有
(2)无色液体A的结构简式为
(3)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是
(4)下列关于仪器的组装或使用正确的是_______(填标号)。
| A.抽滤可以加快过滤速率,得到较干燥的沉淀 |
| B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触 |
| C.图甲回流搅拌装置应采用直接加热的方法 |
| D.冷凝管中水的流向是下进上出 |
(6)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,用0.1mol/L的KOH标准溶液进行滴定,中和滴定时应该使用的指示剂为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


