解答题-原理综合题 适中0.65 引用1 组卷35
二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
(1)甲醇是一种可再生能源,可由CO2和H2制备:
反应1: △H1,
△H1,
反应Ⅱ: △H2
△H2
已知部分相关物质的标准燃烧热和标准熵数值如下表:
①△H2______ 0(填“>”或“<”)。
②反应Ⅱ能自发进行的最低温度为______ K(保留小数点后1位)。
(2)常温下,将一定量甲醇放入真空的恒容密闭容器中,发生: 。
。
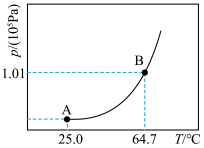
①甲醇达到液气平衡状态时的压强,称为甲醇该温度下的饱和蒸汽压(p),p与温度关系如图所示。请分析B点蒸气压大于A点蒸气压的原因____________ 。______ (用字母表示)。
已知溶液上方蒸气的总压p总=54.86kPa, ,
, 为甲醇蒸气分压,x(CH3OH)为甲醇和水的蒸气中CH3OH的物质的量分数。64.7℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数
为甲醇蒸气分压,x(CH3OH)为甲醇和水的蒸气中CH3OH的物质的量分数。64.7℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数______ 0.4(填“>”、“<”或“=”),解释采用蒸馏可获得较高浓度甲醇的原因____________ 。
(3)工业用甲醇空气氧化法制甲醛,催化剂为铁钼氧化物。
 K v
K v
该反应分两步完成:
反应Ⅰ: K1
K1 
反应Ⅱ: K2
K2 
v、v1、v2表示化学反应速率,k1、k2为速率常数,分压P等于其物质的量分数乘以总压, 为氧化态催化剂的物质的量分数:
为氧化态催化剂的物质的量分数: 为还原态催化剂的物质的量分数:反应Ⅰ为决速步。下列说法
为还原态催化剂的物质的量分数:反应Ⅰ为决速步。下列说法不正确 的是______。
(4)利用电化学原理可同时将SO2,CO2变废为宝,装置如图所示(电极均为惰性电极)。______ 极(填“正”或“负”)
②d电极反应式为______ 。
③若b电极消耗16 gO2则Y中左侧溶液质量减轻______ g。
(1)甲醇是一种可再生能源,可由CO2和H2制备:
反应1:
反应Ⅱ:
已知部分相关物质的标准燃烧热和标准熵数值如下表:
化学式 | |||
标准燃烧热(25℃)△H/kJ·mol-1 | -726.5 | -285.8 | -283.0 |
标准熵:S/(J·mol-1·K-1) | 126.8 | 130.7 | 197.7 |
②反应Ⅱ能自发进行的最低温度为
(2)常温下,将一定量甲醇放入真空的恒容密闭容器中,发生:
①甲醇达到液气平衡状态时的压强,称为甲醇该温度下的饱和蒸汽压(p),p与温度关系如图所示。请分析B点蒸气压大于A点蒸气压的原因

物质 | 甲醇 | 水 | 甲醇水溶液(甲醇物质的量分数为0.4) | |
饱和蒸气压/kPa | 101.3 | 23.90 | 甲醇 | 水 |
40.52 | 14.34 | |||
(3)工业用甲醇空气氧化法制甲醛,催化剂为铁钼氧化物。
该反应分两步完成:
反应Ⅰ:
反应Ⅱ:
v、v1、v2表示化学反应速率,k1、k2为速率常数,分压P等于其物质的量分数乘以总压,
| A. |
| B.用铁钼氧化物来提高甲醇的平衡转化率 |
| C.总反应速率 |
| D.增大O2的分压,有利于增大HCHO的生成速率 |
(4)利用电化学原理可同时将SO2,CO2变废为宝,装置如图所示(电极均为惰性电极)。
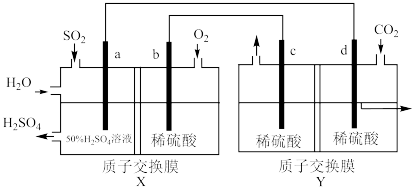
②d电极反应式为
③若b电极消耗16 gO2则Y中左侧溶液质量减轻
23-24高三上·安徽马鞍山·阶段练习
类题推荐
甲醇(CH3OH)在化学工业、农业生产等领域有着广泛应用。回答下列问题:
(1)CH3OH的电子式为___________ 。
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的___________ 。已知相关物质的燃烧热数值如下表,则反应CO(g)+2H2(g) CH3OH(l)的∆H=
CH3OH(l)的∆H=___________ 。
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l) CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。
①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是___________ 。
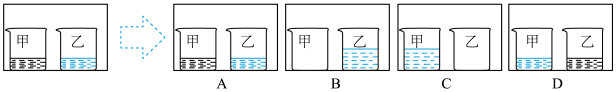
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到___________ (填字母)所示的现象。___________ kPa,馏分中甲醇的物质的量分数为___________ 。
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为___________ kW⋅h⋅kg-1(结果保留一位小数)。已知: 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。
②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的___________ 极相连,Al电极上发生的电极反应方程式为___________ 。
(1)CH3OH的电子式为
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的
| 物质 | CO(g) | H2(g) | CH3OH(l) |
| 燃烧热/kJ·mol-1 | -283.0 | -285.8 | -726.5 |
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l)
①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是
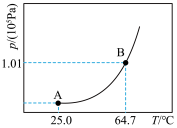
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到

| 物质 | CH3OH(l) | H2O(1) |
| p*(64.7℃)/kPa | 101.30 | 23.90 |
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为
②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的
工业生产硝酸的核心反应之一是在恒压装置中将NO转化为 :
:
反应Ⅰ:

目前认为反应Ⅰ分两步进行:
反应Ⅱ:

反应Ⅲ:

回答下列问题:
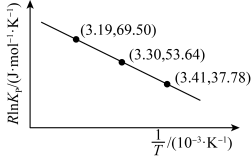
(1)已知: (C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
(C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
_____  。该工艺适宜的压强条件是
。该工艺适宜的压强条件是_____ (填“高压”或“低压”)。
(2)Raoult定律表明:一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象_____ (用字母表示)。
(3)控制原料比 ,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当
,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当 、90℃时,NO转化率达到50%的过程中,
、90℃时,NO转化率达到50%的过程中,
_____  (保留3位有效数字)。
(保留3位有效数字)。
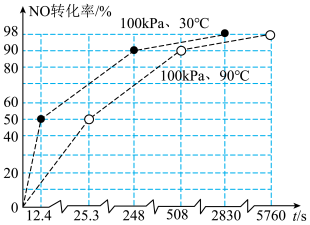
(4)由图可知,反应Ⅰ的速率随温度升高而_____ (填“增大”“减小”或“不变”),可能的原因是_____ 。[已知反应Ⅱ为快速平衡, ,反应Ⅲ的速率方程为
,反应Ⅲ的速率方程为 ]。
]。
(5)T℃、 时,控制原料比
时,控制原料比 发生反应Ⅰ(
发生反应Ⅰ( 由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
_____ 。
(6)已知不同温度下反应Ⅰ的浓度平衡常数 如表。
如表。
NO由 催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有_____ (写出两条即可)。
反应Ⅰ:
目前认为反应Ⅰ分两步进行:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)已知:

(2)Raoult定律表明:一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象

(3)控制原料比

(4)由图可知,反应Ⅰ的速率随温度升高而
(5)T℃、
(6)已知不同温度下反应Ⅰ的浓度平衡常数
| 温度/℃ | 27 | 77 | 127 | 177 | 227 | 500 |
| 平衡常数 | 1.0 |
为减少CO2排放、科学家着眼于能源转换和再利用等问题。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
则反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)的∆H=_______ kJ•mol-1。
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是_______ (填编号)。
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为_______ 。
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
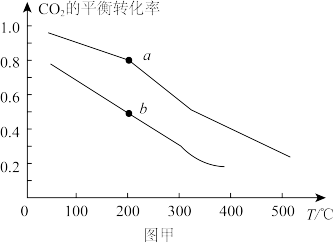
a、b两点正反应速率分别用va、vb表示,则va_______ vb(填“大于”、“小于”或“等于”)。
b点对应的平衡常数Kp=_______ MPa-2(Kp为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
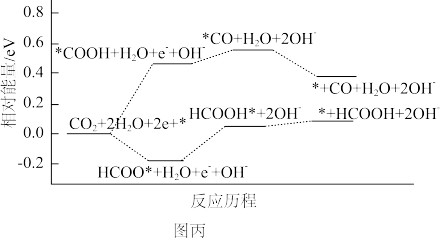
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。
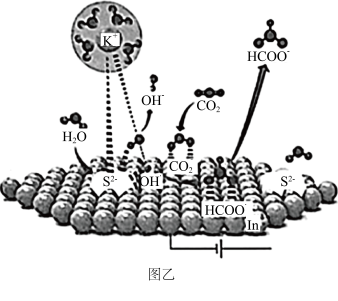
①图乙中,催化剂S2-活性位点在催化过程中的作用是_______ 。
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为_______ ,从反应能垒角度分析该催化剂对生成甲酸具有高选择性的原因:_______ 。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
| 化学键 | C=O | C-H | H-H | H-O |
| 键能/kJ•mol-1 | 745.0 | 413.4 | 436.0 | 462.8 |
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。

a、b两点正反应速率分别用va、vb表示,则va
b点对应的平衡常数Kp=
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。

①图乙中,催化剂S2-活性位点在催化过程中的作用是
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


