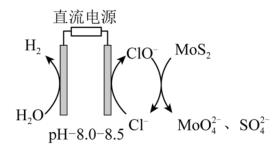
解答题-工业流程题 适中0.65 引用3 组卷137
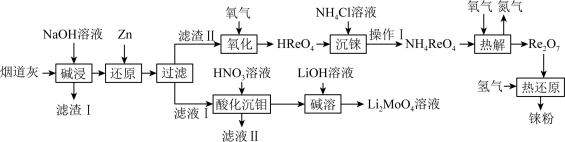
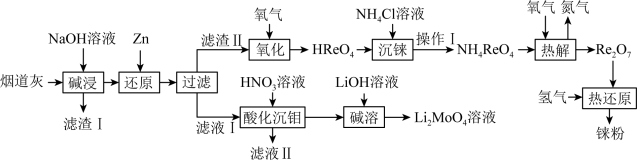
铼(Re)被誉为“金属之王”,用于航空航天发动机制造等领域。以含铼废料(主要含 、
、 、CuO等)为原料制备铼的流程如下:
、CuO等)为原料制备铼的流程如下: )是白色片状晶体,微溶于冷水,溶于热水。
)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)下列状态Zn的最外层电子排布式中,能量最高的是___________(填字母)。
(2)根据上述流程图预测:铼在金属活动顺序表中位置在___________(填字母)。
(3) 是酸性氧化物。“还原”中主要离子方程式为
是酸性氧化物。“还原”中主要离子方程式为___________ 。“热解”中得到 的化学方程式:
的化学方程式:___________ 。
(4)“沉铼”中,用___________ (填“热水”或“冰水”)洗涤过铼酸铵,确认 洗涤干净的方法是
洗涤干净的方法是___________ 。
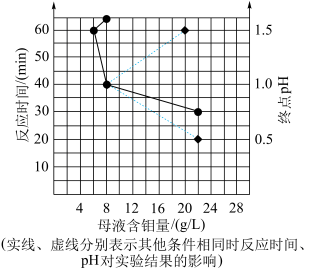
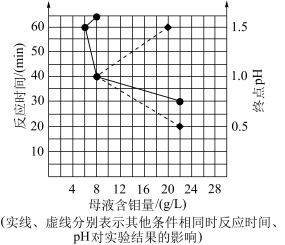
(5)用 制备
制备 的另一种方案是:第1步,用有机溶剂萃取得到含铼有机相;第2步,用氨水反萃取得到
的另一种方案是:第1步,用有机溶剂萃取得到含铼有机相;第2步,用氨水反萃取得到 溶液。相对“沉铼”法,该工艺优点是
溶液。相对“沉铼”法,该工艺优点是___________ 。
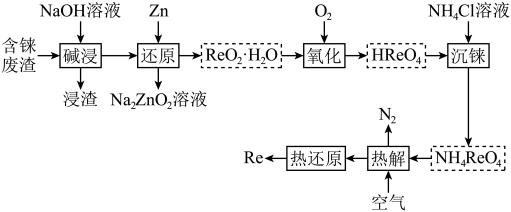
回答下列问题:
(1)下列状态Zn的最外层电子排布式中,能量最高的是___________(填字母)。
A.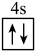 | B.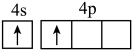 | C.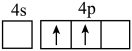 | D.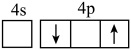 |
(2)根据上述流程图预测:铼在金属活动顺序表中位置在___________(填字母)。
| A.Na之前 | B.Mg、Al之间 | C.Zn、Cu之间 | D.Ag之后 |
(3)
(4)“沉铼”中,用
(5)用
2024·湖北·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网