解答题-原理综合题 较难0.4 引用1 组卷162
应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
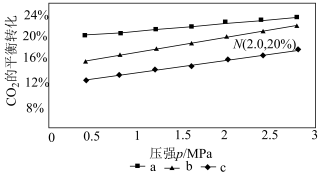
、 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
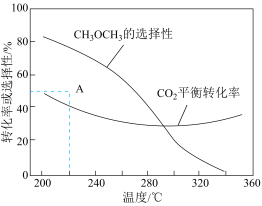
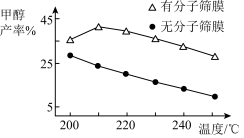
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。
I.
II.
(1)反应过程中各物质的相对能量变化情况如图所示:

(2)若
| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应

②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
2024·黑龙江哈尔滨·模拟预测
类题推荐
甲醇是一种基本的有机化工原料,用途十分广泛。应用 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应 ,需通过以下两步实现:
,需通过以下两步实现:
Ⅰ.
Ⅱ.
(1)反应过程中各物质的相对能量变化情况如图所示。
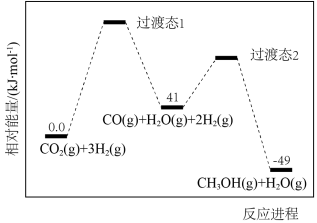

_______ 。
(2)若 ,下列温度下反应能自发进行的是_______(填序号)。
,下列温度下反应能自发进行的是_______(填序号)。
(3)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出 )的两个同体积容器中通入
)的两个同体积容器中通入 和
和 ,甲醇的产率随温度的变化如图所示。温度相同时,有分子筛膜的容器中甲醇的产率大于无分子监膜的原因为
,甲醇的产率随温度的变化如图所示。温度相同时,有分子筛膜的容器中甲醇的产率大于无分子监膜的原因为_______ 。
(4)按照 投料,在恒容密闭容器中进行反应,
投料,在恒容密闭容器中进行反应, 的平衡转化率随温度和压强变化如图所示。
的平衡转化率随温度和压强变化如图所示。
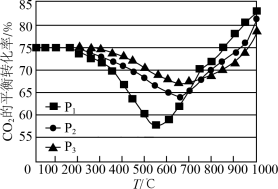
①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是_______ 。
②压强为 时,温度高于
时,温度高于 之后,随着温度升高平衡转化率增大的原因是
之后,随着温度升高平衡转化率增大的原因是_______ ;
③同时增大 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是_______ 。
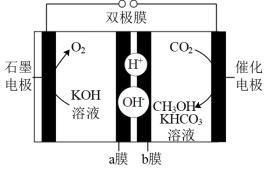
④一种应用双极膜(由阳离子和阴离子交换膜构成)通过电化学还原 制备甲醇的电解原理如图所示。催化电极的电极反应式为
制备甲醇的电解原理如图所示。催化电极的电极反应式为_______ ,双极膜内每消耗 水,理论上石墨电极产生标准状况下
水,理论上石墨电极产生标准状况下_______  。
。
Ⅰ.
Ⅱ.
(1)反应过程中各物质的相对能量变化情况如图所示。

(2)若
| A. | B.10℃ | C. | D. |

(4)按照

①压强
②压强为
③同时增大
④一种应用双极膜(由阳离子和阴离子交换膜构成)通过电化学还原

我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,其中的关键技术是运用催化转化法实现二氧化碳的碳捕集和碳利用。请回答下列问题:
一定温度下,CO2和H2在催化剂作用下可发生a、b两个平行反应,分别生成CH3OH和CO。
a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ•mol-1
b:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ•mol-1
CO(g)+H2O(g) △H2=+41.2kJ•mol-1
(1)相同温度下,反应CO(g)+2H2(g) CH3OH(g)的△H3=
CH3OH(g)的△H3=________ kJ•mol-1。
(2)若CO2(g)+3H2(g) CH3OH(g)+H2O(g) △S=-175J•mol-1•K-1,下列温度下反应能自发进行的是
CH3OH(g)+H2O(g) △S=-175J•mol-1•K-1,下列温度下反应能自发进行的是_______ (填序号)。
(3)投料比 =3,在恒温恒容条件下发生反应,下列说法能作为反应a达到平衡状态的判据是
=3,在恒温恒容条件下发生反应,下列说法能作为反应a达到平衡状态的判据是_______ (填选项字母)。
A.气体密度不再变化
B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化
D. 不再变化
不再变化
E.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
(4)按照n(CO2):n(H2)=1:3投料,在恒容密闭容器中进行反应,CO2的平衡转化率随温度和压强变化如图所示。
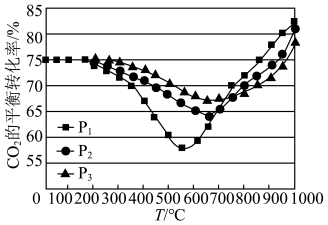
①压强P1、P2、P3由大到小的顺序是_______ 。
②同时增大CO2的平衡转化率和CH3OH的产率可采取的措施是_______ 。
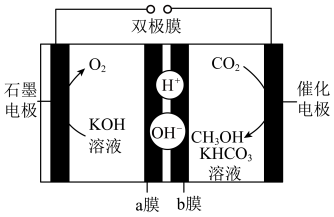
③一种应用双极膜(由阳离子和阴离子交换膜构成)通过电化学还原CO2制备甲醇的电解原理如图所示。催化电极的电极反应式为_______ ,双极膜内每消耗18g水,理论上石墨电极产生标准状况下_______ LO2。
(5)二氧化碳催化加氢制甲醇的反应中[CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0]在起始物
CH3OH(g)+H2O(g) △H<0]在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在T=250℃时,x(CH3OH)随压强(p)的变化及在p=5×103Pa时x(CH3OH)随温度(T)的变化,如图所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在T=250℃时,x(CH3OH)随压强(p)的变化及在p=5×103Pa时x(CH3OH)随温度(T)的变化,如图所示。
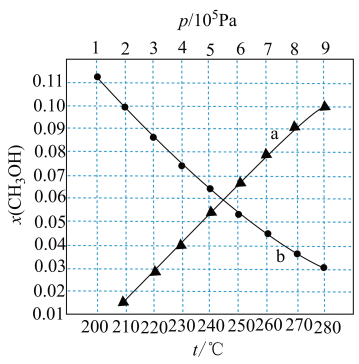
①图中对应等压过程的曲线是_______ (填“a”或“b”)。
②恒温时(T=250℃),当x(CH3OH)=0.10时,CO2的平衡转化率α=_______ (保留小数点后一位),此条件下该反应的Kp=_______ Pa-2。(保留小数点后两位)(对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
一定温度下,CO2和H2在催化剂作用下可发生a、b两个平行反应,分别生成CH3OH和CO。
a:CO2(g)+3H2(g)
b:CO2(g)+H2(g)
(1)相同温度下,反应CO(g)+2H2(g)
(2)若CO2(g)+3H2(g)
| A.5℃ | B.10℃ | C.50℃ | D.500℃ |
(3)投料比
A.气体密度不再变化
B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化
D.
E.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
(4)按照n(CO2):n(H2)=1:3投料,在恒容密闭容器中进行反应,CO2的平衡转化率随温度和压强变化如图所示。

①压强P1、P2、P3由大到小的顺序是
②同时增大CO2的平衡转化率和CH3OH的产率可采取的措施是
③一种应用双极膜(由阳离子和阴离子交换膜构成)通过电化学还原CO2制备甲醇的电解原理如图所示。催化电极的电极反应式为

(5)二氧化碳催化加氢制甲醇的反应中[CO2(g)+3H2(g)

①图中对应等压过程的曲线是
②恒温时(T=250℃),当x(CH3OH)=0.10时,CO2的平衡转化率α=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网