解答题-工业流程题 适中0.65 引用1 组卷98
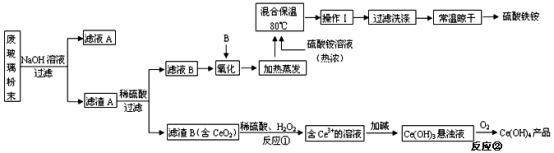
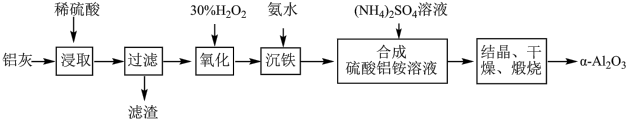
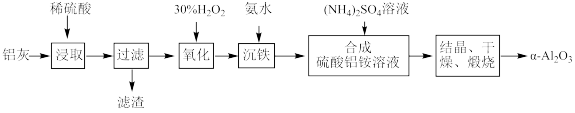
硫酸铵[(NH4)2SO4]俗称硫铵、肥田粉。模拟以黄铁矿(主要成分为FeS2)为原料制备硫酸铵的一种流程如图所示:
(1)步骤ⅲ的目的是____________ 。
(2)“煅烧”过程中发生反应的化学方程式为_____________ ;在该反应中,36.0gFeS2完全反应时转移______ mol电子。
(3)合成氨反应中,1molN2和4molH2在催化剂、高温、高压作用下合成NH3的物质的量_______ (填“>”“<”或“=”)2mol。
(4)如果直接用水吸收SO3,会形成大量“酸雾”,污染环境。由此推知,SO3和H2O的反应是_____ (填“吸”或“放”)热反应。
(5)利用Fe3O4可以制备高纯度铁红,其步骤如下:
步骤1:用足量稀硫酸溶解Fe3O4。
步骤2:向溶液中加入足量双氧水,氧化亚铁离子。
步骤3:加入过量NaOH溶液,过滤﹑洗涤、灼烧。
步骤2中氧化亚铁离子的离子方程式为_________________ 。
(6)测定硫酸铵产品纯度(假设杂质不参加反应):取Wg硫酸铵产品于试管中,向其中加入足量NaOH溶液,共热;产生的气体用V1mLc1mol/L盐酸吸收,得到吸收液;再向吸收液中滴加V2mLc2mol/LNaOH溶液恰好完全中和过量的盐酸。该产品中(NH4)2SO4的质量分数为________ (用含c1、V1、c2、V2、W的代数式表示)。
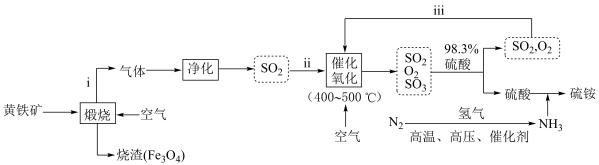
(1)步骤ⅲ的目的是
(2)“煅烧”过程中发生反应的化学方程式为
(3)合成氨反应中,1molN2和4molH2在催化剂、高温、高压作用下合成NH3的物质的量
(4)如果直接用水吸收SO3,会形成大量“酸雾”,污染环境。由此推知,SO3和H2O的反应是
(5)利用Fe3O4可以制备高纯度铁红,其步骤如下:
步骤1:用足量稀硫酸溶解Fe3O4。
步骤2:向溶液中加入足量双氧水,氧化亚铁离子。
步骤3:加入过量NaOH溶液,过滤﹑洗涤、灼烧。
步骤2中氧化亚铁离子的离子方程式为
(6)测定硫酸铵产品纯度(假设杂质不参加反应):取Wg硫酸铵产品于试管中,向其中加入足量NaOH溶液,共热;产生的气体用V1mLc1mol/L盐酸吸收,得到吸收液;再向吸收液中滴加V2mLc2mol/LNaOH溶液恰好完全中和过量的盐酸。该产品中(NH4)2SO4的质量分数为
23-24高一下·河南濮阳·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网