解答题-实验探究题 较难0.4 引用2 组卷105
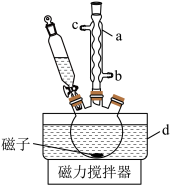
消毒剂对新冠疫情防控有着重要作用。过氧乙酸( )是一种常用的消毒剂,易溶于水,有强氧化性,温度高于40 ℃易分解。制备过氧乙酸的一种方法如下(装置如图所示)。
)是一种常用的消毒剂,易溶于水,有强氧化性,温度高于40 ℃易分解。制备过氧乙酸的一种方法如下(装置如图所示)。 .将冰醋酸、
.将冰醋酸、 在三颈烧瓶中混合,置于冰水浴中,不断搅拌下,分批缓慢加入浓硫酸。
在三颈烧瓶中混合,置于冰水浴中,不断搅拌下,分批缓慢加入浓硫酸。
 .常温下搅拌48小时。
.常温下搅拌48小时。
 .分离出过氧乙酸。
.分离出过氧乙酸。
 .检测产品纯度。
.检测产品纯度。
回答下列问题:
(1)仪器a的名称是___________ ,该仪器的出水口是___________ (填“b”或“c”)。
(2)步骤 中,分批缓慢加入浓硫酸并使用冰水浴,目的是
中,分批缓慢加入浓硫酸并使用冰水浴,目的是___________ 。
(3)制备过氧乙酸反应的化学方程式是___________ 。
(4)步骤 中,分离出过氧乙酸的方法是减压蒸馏,采用该方法的原因是
中,分离出过氧乙酸的方法是减压蒸馏,采用该方法的原因是___________ 。
(5)步骤 检测产品(含有杂质
检测产品(含有杂质 和
和 )中过氧乙酸的含量的方法如下。
)中过氧乙酸的含量的方法如下。
i.称取3.000 g样品,溶解,在100 mL容量瓶中定容。
ii.在锥形瓶中加入10.00 mL待测液、5 mL硫酸,用 高锰酸钾标准溶液滴定至溶液呈浅红色,消耗高锰酸钾标准溶液
高锰酸钾标准溶液滴定至溶液呈浅红色,消耗高锰酸钾标准溶液 ,高锰酸钾完全参与反应。
,高锰酸钾完全参与反应。
iii.再向锥形瓶中加入 溶液(足量),摇匀后在暗处放置5 min,用
溶液(足量),摇匀后在暗处放置5 min,用 ,标准溶液滴定(指示剂是淀粉),消耗
,标准溶液滴定(指示剂是淀粉),消耗 标准溶液
标准溶液 。
。
已知:(i) 。
。
(ii)酸性环境中 和
和 都能将
都能将 氧化为
氧化为 。
。
(iii)酸性环境中 不能氧化
不能氧化 。
。
①步骤iii中判断滴定终点的现象是___________ 。
②步骤ii的作用是___________ 。
③产品中过氧乙酸的质量分数是___________ (用代数式表示)。
回答下列问题:
(1)仪器a的名称是
(2)步骤
(3)制备过氧乙酸反应的化学方程式是
(4)步骤
(5)步骤
i.称取3.000 g样品,溶解,在100 mL容量瓶中定容。
ii.在锥形瓶中加入10.00 mL待测液、5 mL硫酸,用
iii.再向锥形瓶中加入
已知:(i)
(ii)酸性环境中
(iii)酸性环境中
①步骤iii中判断滴定终点的现象是
②步骤ii的作用是
③产品中过氧乙酸的质量分数是
23-24高三下·湖南衡阳·开学考试
类题推荐
过一硫酸氢钾(KHSO5)具有极强的水溶性和腐蚀性,是一种常见的消毒剂。实验室常用过一硫酸与碳酸钾制取过一硫酸氢钾,制取装置及步骤如下:
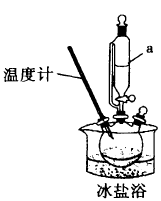
Ⅰ.将一定量已预冷的双氧水溶液加入三颈烧瓶,放入冰盐浴中,加入双氧水稳定剂,不断搅拌并缓慢加浓硫酸,制取过一硫酸。
Ⅱ.分批向三颈烧瓶中加入碳酸钾固体,保持一定温度下,搅拌30分钟。
Ⅲ.将粗产品低温冷却结晶,过滤,用无水乙醇洗涤沉淀,烘干,得过一硫酸氢钾。
回答下列问题:
(1)步骤Ⅰ制取过一硫酸的化学方程式为___________ 。
(2)指出装置图中的一处明显错误___________ ;仪器a的名称是___________ 。
(3)过一硫酸氢钾产物产率(以活性氧含量表示)随温度、稳定剂种类的变化如表:
根据实验数据分析,制备过一硫酸氢钾的最优条件为___________ 、___________ 。
(4)过滤后,用无水乙醇替代蒸馏水洗涤沉淀的目的是___________ 。
(5)测定过一硫酸氢钾(KHSO5)的质量分数。
①称量m g样品配制成500 mL溶液,取50 mL溶液于锥形瓶中,加入稀硫酸酸化,用c mol/L标准KMnO4溶液滴定至终点,滴定终点的现象为___________ 。
②若消耗KMnO4溶液V mL,则该样品中过一硫酸氢钾的质量分数表达式为___________ 。
(已知 )
)

Ⅰ.将一定量已预冷的双氧水溶液加入三颈烧瓶,放入冰盐浴中,加入双氧水稳定剂,不断搅拌并缓慢加浓硫酸,制取过一硫酸。
Ⅱ.分批向三颈烧瓶中加入碳酸钾固体,保持一定温度下,搅拌30分钟。
Ⅲ.将粗产品低温冷却结晶,过滤,用无水乙醇洗涤沉淀,烘干,得过一硫酸氢钾。
回答下列问题:
(1)步骤Ⅰ制取过一硫酸的化学方程式为
(2)指出装置图中的一处明显错误
(3)过一硫酸氢钾产物产率(以活性氧含量表示)随温度、稳定剂种类的变化如表:
| 稳定剂种类 | 活性氧含量/% | ||||
| -12℃ | -8℃ | -4℃ | 0℃ | ||
| 水杨酸 | 2.3 | 2.9 | 3.6 | 2.2 | 1.4 |
| 聚乙二醇 | 2.6 | 3.1 | 3.8 | 2.7 | 1.9 |
| 3.3 | 3.8 | 4.5 | 3.3 | 2.7 | |
| 2.6 | 3.2 | 4.2 | 2.5 | 2.2 |
(4)过滤后,用无水乙醇替代蒸馏水洗涤沉淀的目的是
(5)测定过一硫酸氢钾(KHSO5)的质量分数。
①称量m g样品配制成500 mL溶液,取50 mL溶液于锥形瓶中,加入稀硫酸酸化,用c mol/L标准KMnO4溶液滴定至终点,滴定终点的现象为
②若消耗KMnO4溶液V mL,则该样品中过一硫酸氢钾的质量分数表达式为
(已知
高铁酸钾( )是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾(
)是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾( )可用于自来水的杀菌消毒和净化,一种由磁铁矿(主要成分为
)可用于自来水的杀菌消毒和净化,一种由磁铁矿(主要成分为 ,还含有少量的
,还含有少量的 、
、 、
、 等)制备高铁酸钾的过程如下图所示:
等)制备高铁酸钾的过程如下图所示:
①高铁酸钾( )难溶于醇等有机溶剂;
)难溶于醇等有机溶剂;
②25℃时部分难溶物的溶度积如下:
回答下列问题:
(1)“酸溶”后得到的滤渣的主要成分为___________ 。
(2)加入 “氧化”过程主要发生的离子方程式为
“氧化”过程主要发生的离子方程式为___________ 。
(3)根据制备过程,步骤“调 ”过程应控制
”过程应控制 范围
范围___________ (已知:氧化后镁、铝离子浓度为0.01 ,当离子浓度小于
,当离子浓度小于 时认为离子沉淀完全)。“氧化、过滤”过程中生成
时认为离子沉淀完全)。“氧化、过滤”过程中生成 ,写出该过程的离子方程式:
,写出该过程的离子方程式:___________ 。
(4) 粗产品含有
粗产品含有 、
、 等杂质,用
等杂质,用___________ 方法进行分离提纯,其提纯步骤为:将一定量的 粗产品溶于冷的3
粗产品溶于冷的3
 溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和
溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和 溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用
溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用___________ (填标号)。
a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(5)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:



现称取a g高铁酸钾( )(摩尔质量为M
)(摩尔质量为M )样品溶于过量的碱性亚铬酸盐
)样品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在250
溶液中,充分反应后过滤,滤液在250 容量瓶中定容,每次取25.00
容量瓶中定容,每次取25.00 于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c
于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c 标准溶液滴定至终点,消耗标准溶液V
标准溶液滴定至终点,消耗标准溶液V ,该产品中高铁酸钾(
,该产品中高铁酸钾( )的纯度为
)的纯度为___________ (用含a、M、c、V的代数式表示)。

①高铁酸钾(
②25℃时部分难溶物的溶度积如下:
(1)“酸溶”后得到的滤渣的主要成分为
(2)加入
(3)根据制备过程,步骤“调
(4)
a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(5)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
现称取a g高铁酸钾(
过氧乙酸(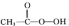 ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
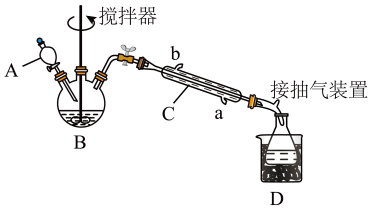
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是____ ,仪器C中冷水流入口是____ (填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是_____ 。
(3)生成过氧乙酸的化学方程式为____ 。
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_____ ,最佳反应时间约_____ 。
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。则产品中过氧乙酸的物质的量浓度是____ mol·L-1(保留2位小数)。
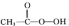 ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是
(2)为更好地控制反应温度,应采用的加热方法是
(3)生成过氧乙酸的化学方程式为
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是
| 反应物比例CH3COOH/H2O2 | 反应时间 | ||||
| 0.5h | 1h | 3h | 5h | 7h | |
| 2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% |
| 1:1 | 0.56% | 12.92% | 13.54% | 20.72% | 20.80% |
| 1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


