解答题-工业流程题 较难0.4 引用1 组卷84
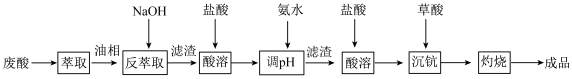
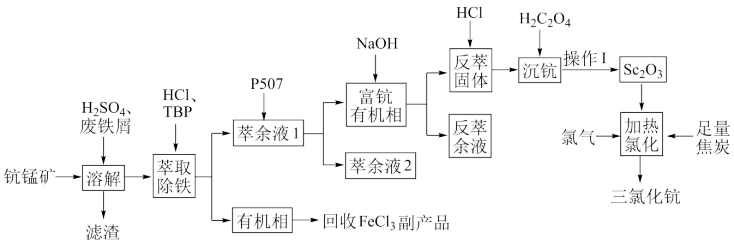
氧化钪( )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有___________ (写出一种)。
(2)“浸取”时铁屑被 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
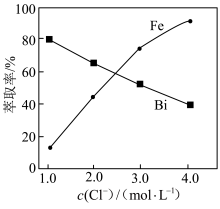
(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为___________ 。___________ 。
(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中 的浓度为
的浓度为___________ 。
(6)已知 ,
, ,
, 。“沉钪”时,发生反应
。“沉钪”时,发生反应 ,此反应的平衡常数
,此反应的平衡常数
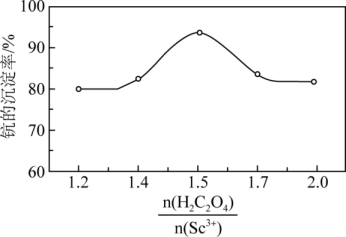
___________ (用含a、b、c的代数式表示)。反应过程中,草酸用量过多时,航的沉淀率下降,原因可能是___________ 。
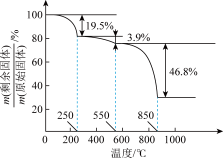
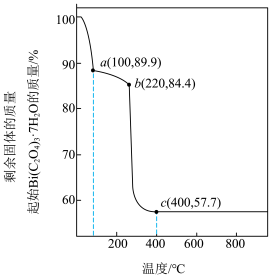
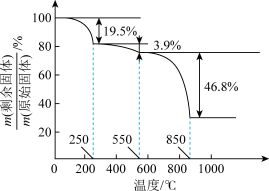
(7)草酸钪晶体 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为___________ 。
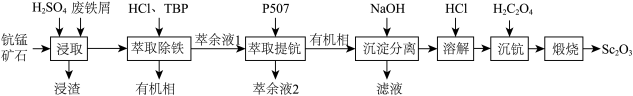
回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有
(2)“浸取”时铁屑被
(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为

(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中
(6)已知
(7)草酸钪晶体
23-24高三下·湖南衡阳·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网